Ботокс пор. д/р-ра д/ин. 200 ЕД-Аллерган фл. №1
Аллерган Фармасьютікалз, ІрландіяСостав
іюча речовина: ботулінічний токсин типу А (від Clostridium botulinum);
1 флакон містить ботулінічний токсин типу А (від Clostridium botulinum) 100 або 200 одиниць - Аллерган (ОД-Аллерган);
допоміжні речовини: людський альбумін, натрію хлорид.
Лікарська форма.
Порошок для розчину для ін’єкцій.
Основні фізико-хімічні властивості: порошок білого кольору. Відновлений розчин повинен бути прозорим та безбарвним без сторонніх часток. Допускається незначне помутніння та пожовтіння. Перед ін’єкцією препарат повинен бути відновлений у стерильному 0,9 % розчині натрію хлориду.
Фармакотерапевтична група. Міорелаксанти із периферичним механізмом дії. Ботулінічний токсин.
Код ATX. М0ЗАХ01.
Імунологічні та біологічні властивості
Фармакодинаміка.
Ботулінічний токсин типу А блокує периферичне виділення ацетилхоліну у пресинаптичних холінергічних нервових закінченнях шляхом розщеплення SNAP-25, невід’ємної частини зчеплення та виділення ацетилхоліну везикулами, розташованими у нервових закінченнях.
Після ін’єкції відбувається первинне швидке зв’язування токсину поверхневими рецепторами певних клітин. Після цього відбувається передача токсину через мембрану плазми за допомогою опосередкованого рецепторами ендоцитозу.
Потім токсин виділяється у цитозоль. Останній процес супроводжується поступовим уповільненням виділення ацетилхоліну, клінічні ознаки проявляються упродовж 2 - 3 днів, максимальний ефект можна побачити за 5 - 6 тижнів після ін’єкцій.
Відновлення після внутрішньом’язової ін’єкції відбувається упродовж 12 тижнів, оскільки нервові закінчення відростають і відновлюють зв’язок із кінцевою пластинкою. Після підшкірної ін’єкції, коли метою є пахвові потові залози, у пацієнтів, яким ввели 50 одиниць - Аллерган у кожну пахву, ефект після першої ін’єкції триває від 7,5 місяців до року і більше. Однак у 27,5 % пацієнтів ефект спостерігався протягом 1 року та більше.
Відновлення симпатичних нервових закінчень, що іннервують потові залози, після підшкірної ін’єкції препарату не вивчалося.
Внаслідок внутрішньої ін’єкції в детрузор, препарат БОТОКС® діє на еферентні шляхи діяльності детрузора шляхом стримування вивільнення ацетилхоліну. Також, препарат БОТОКС® може стримувати аферентні нейротрансміттери і сенсорні шляхи.
Дані клінічних досліджень.
Ідіопатична гіперактивність сечового міхура.
Були проведені два рандомізованих, подвійно-сліпих, плацебо-контрольованих, у паралельних групах, мультицентрових дослідження Фази 3 у пацієнтів із гіперактивним сечовим міхуром з симптомами нетримання сечі, ургентного та прискореного сечовипускання, з тривалістю дослідження – 24 тижні. Було залучено у загальній кількості 1105 пацієнтів, що не мали достатнього адекватного ефекту від застосування хоча б одного антихолінергічного засобу (недостатня реакція на лікування або неприйнятні побічні ефекти). Ці пацієнти були рандомізовані у групи для отримання препарату БОТОКС® 100 одиниць - Аллерган (кількість – 557) або плацебо (кількість – 548).
В обох дослідженнях значні покращення, у порівнянні з плацебо в основній змінній ефективності від початкового рівня, що вимірювались частотою епізодів нетримання сечі протягом тижня, спостерігались на користь препарату БОТОКС® (100 одиниць - Аллерган) в основний проміжок ефективності на 12 тижні (5,49 у групі БОТОКС® та 5,39 у групі плацебо), враховуючі відсоток «сухих» пацієнтів. За допомогою Шкали переваг лікування було визначено, що в двох дослідженнях кількість пацієнтів, які мали позитивну реакцію на лікування (їх стан був визначений як «набагато покращився» або «покращився»), була значно більшою у групі, що отримувала БОТОКС®, у порівнянні із групою плацебо. Також у порівнянні із групою плацебо спостерігалося значне покращення таких симптомів, як частота сечовипускання, ургентність позовів до сечовипускання та ноктурія. Об’єм сечовипускання за один акт був також значно більшим. Загалом, з 2-го тижня спостерігалося значне покращення у пацієнтів із симптомами гіперактивного сечового міхура.
Лікування препаратом БОТОКС® пов’язане зі значним покращенням у порівнянні з групою плацебо за показниками якості життя, обумовленими станом здоров’я, що були виміряні за результатами Анкети якості життя у пацієнтів із нетриманням сечі (I-QOL), включаючи поведінку ухилення, психологічний вплив і соціальне збентеження, та за результатами анкети Кінга (KHQ-King’s Health Questionnaire), включаючи вплив нестримання, обмеження ролі, обмеження соціальної активності, фізичні обмеження, особистих взаємовідносин, емоцій, сну/енергії, вимірювання важкості психологічної адаптації.
Не було виявлено суттєвої різниці у ефективності після лікування препаратом БОТОКС® між пацієнтами ≥ 65 років та пацієнтами ≤ 65 років.
Первинні та вторинні кінцеві точки на початку дослідження і відхилення від вихідного рівня в об’єднаних базових дослідженях:
|
БОТОКС® 100 одиниць -Аллерган Кількість – 557 |
Плацебо Кількість – 548 |
|
|
|
Частота епізодів нетримання сечі у день* |
|||
|
Середній базовий рівень |
5,49 |
5,39 |
|
|
Середня зміна на 2-му тижні |
|
|
<0,001 |
|
Середня зміна на 6-му тижні |
|
|
<0,001 |
|
Середня зміна на 12-му тижні |
|
|
<0,001 |
|
Відсоток позитивної відповіді на лікування із застосуванням Шкали переваг лікування (%) Тиждень 2 Тиждень 6 Тиждень 12а |
64,4 68,1 61,8 |
34,7 32,8 28,0 |
<0,001 <0,001 <0,001 |
|
Частота епізодів сечовипускання у день Кількість Середній базовий рівень Середня зміна на 2-му тижні Середня зміна на 6-му тижні Середня зміна на 12-муb тижні |
11,99
|
11,48
|
<0,001 <0,001 <0,001 |
|
Частота невідкладних позивів до сечовипускання у день Кількість Середній базовий рівень Середня зміна на 2-му тижні Середня зміна на 6-му тижні Середня зміна на 12-муb тижні |
8,82
|
8,31
|
<0,001 <0,001 <0,001 |
|
Показник якості життя за результатами анкети якості життя у пацієнтів із нетриманням сечі (I-QOL) Середній базовий рівень Середня зміна на 12-муbc тижні |
34,1 +22,5 |
34,7 +6,6 |
<0,001 |
|
Показник якості життя за результатами анкети Кінга (KHQ - King’s Health Questionnaire): Обмеження ролі Середній базовий рівень Середня зміна на 12-муbc тижні |
65,4
|
61,2
|
<0,001 |
|
Показник якості життя за результатами анкети Кінга (KHQ): Обмеження соціальної активності Середній базовий рівень Середня зміна на 12-муbc тижні |
44,8
|
42,2
|
<0,001 |
* Відсоток «сухих» пацієнтів (без нетримання) на тижні 12 становив 27,1 % у групі БОТОКС® та 8,4 % у групі плацебо. Зменшення випадків нетримання на 75 % та 50 % від базового рівня спостерігалося у 46,0 % та 60,5 % у групі БОТОКС® у порівнянні з 17,7 % та 31,0 % у групі плацебо відповідно.
a Первинна кінцева точка.
b Вторинна кінцева точка.
c Попередньо встановлена мінімальна різниця для загального числа (I-QOL) становила +10 балів і для KHQ -5 балів.
Середня тривалість відповіді після лікування препаратом БОТОКС®, розрахована на основі вимоги пацієнтів на проведення повторного лікування, складала 166 днів (близько 24 тижнів).
Хоча досліджувалась лише обмежена кількість пацієнтів < 40 років (кількість – 88,8 %), не кавказького типу (кількість – 101, 9,1 %), чоловіків (кількість – 135, 12,2 %) у двох клінічних дослідженнях Фази 3, дані цих підгруп були на користь позитивного ефекту від лікування. У чоловіків, порівняно із жінками, частіше спостерігалися такі побічні ефекти як затримка сечі, неповне сечовипускання, полакіурія.
Результати щодо первинних кінцевих точок та зміни до базового рівня у чоловіків в дослідженнях наведені нижче:
|
БОТОКС® 100 одиниць -Аллерган Кількість – 61 |
Плацебо Кількість
|
|
|
|
Частота затримки сечовипускання у день Кількість Середній базовий рівень Середня зміна на 12-му тижні |
5,61
|
4,33
|
0,612 |
|
Відсоток (%) позитивної відповіді на лікування із застосуванням Шкали переваг лікування (користі від лікарського засобу (ТВ) Тиждень 12 |
40,7 |
25,4 |
0,060 |
Загалом 839 пацієнтів взяли участь у довготривалому розширеному відкритому дослідженні (738 жінок та 81 чоловік). Для усіх кінцевих показників ефективності у пацієнтів спостерігалося стале покращення під час повторного лікування. У підгрупі з 345 пацієнтів (316 жінок і 29 чоловіків), що дійшли до 12 тижня 3-го циклу лікування, середнє зниження у частоті нетримання сечі на день становило -3,07, -3,49, -3,49 на тижні 12 після першого, другого та третього лікування препаратом БОТОКС® 100 одиниць - Аллерган відповідно. Відповідний відсоток пацієнтів із позитивною відповіддю на лікування за Шкалою переваг лікування становив 63,6%, 76,9% та 77,3% відповідно. В основних клінічних дослідженнях у жодного із 615 пацієнтів не було виявлено нейтралізуючих антитіл.
Нетримання сечі в результаті нейрогенної гіперактивності детрузора.
Були проведені два подвійних сліпих, плацебо-контрольованих, рандомізованих, мультицентрових клінічних дослідження Фази 3 у пацієнтів із нетриманням сечі внаслідок нейрогенної гіперактивності детрузора, у яких спостерігалось або мимовільне сечовипускання, або пацієнтам застосовували катетеризацію. Було залучено у загальній кількості 691 пацієнт із пошкодженням спинного мозку або розсіяним склерозом, що не мали достатнього ефекту від застосування хоча б одного антихолінергічного засобу. Ці пацієнти були рандомізовані у групи для отримання 200 одиниць - Аллерган препарату БОТОКС® (кількість – 227), 300 одиниць - Аллерган препарату БОТОКС® (кількість – 223) або плацебо (кількість – 241).
В обох дослідженнях Фази 3 значні покращення, у порівнянні з плацебо в первинному аналізі ефективності від початкового рівня, що вимірювався частотою епізодів нетримання сечі протягом тижня, спостерігались на користь препарату БОТОКС® (200 одиниць - Аллерган та 300 одиниць - Аллерган) у проміжному аналізі показників ефективності на 6-му тижні, враховуючі відсоток «сухих» пацієнтів. Спостерігались значні покращення в уродинамічних параметрах, включаючи максимальне збільшення цистометричного об’єму і зменшення граничного тиску детрузора під час першого мимовільного скорочення. Також спостерігалось значне покращення, у порівнянні з плацебо, у пацієнтів із нетриманням сечі за специфічними показниками якості життя, що обумовлені станом здоров’я, що були виміряні за результатами анкети якості життя у пацієнтів із нетриманням сечі (I-QOL), включаючи поведінку ухилення, психологічний вплив і соціальне збентеження. Не було продемонстровано додаткових переваг 300 одиниць - Аллерган у порівнянні з 200 одиницями - Аллерган препарату БОТОКС®, та більш сприятливий профіль безпеки був продемонстрований застосуванням 200 одиниць - Аллерган препарату БОТОКС®.
Первинні та вторинні кінцеві точки та зміни до базового рівня:
|
БОТОКС® 200 одиниць -Аллерган Кількість – 227 |
Плацебо Кількість
|
|
|
|
Тижнева частота епізодів нетримання сечі * |
|
||
|
Середній базовий рівень |
32,4 |
31,5 |
|
|
Середня зміна на 2-му тижні |
|
|
p<0,001 |
|
Середня зміна на 6-му тижні |
|
|
p<0,001 |
|
Середня зміна на тижні 12 |
|
|
p<0,001 |
|
Максимальна цистометрична спроможність (мл) Середній базовий рівень Середня зміна на 6-му тижні |
250,2 +153,6 |
253,5 +11,9 |
p<0,001 |
|
Максимальний тиск детрузора під час першого мимовільного стиснення детрузора (cmH20) Середній базовий рівень Середня зміна на 6-муb тижні |
51,5
|
47,3 +1,1 |
p<0,001 |
|
Загальний показник якості c, d Середній базовий рівень Середня зміна на 6-муb тижні Середня зміна на 12-му тижні |
35,37 +25,89 +28,89 |
35,32 +11,15 +8,86 |
p<0,001 p<0,001 |
* Відсоток «сухих» пацієнтів (без нетримання) упродовж 6 тижня становив 37 % у групі БОТОКС® 200 одиниць - Аллерган та 9 % у групі плацебо. Пропорція зменшення досягла щонайменше 75 % зменшення відносно базового рівня у випадках нетримання сечі складав 63 % та 24 % відповідно. Відсоток 50 % зменшення відносно базового рівня складав 76% та 39% відповідно.
a Первинна кінцева точка.
b Вторинна кінцева точка.
c Показник якості життя за результатами Анкети якості життя у пацієнтів із нетриманням сечі (I-QOL) становить від 0 балів (проблематично) до 100 балів (без проблем).
dПід час базового дослідження попередньо встановлена мінімальна важлива різниця (MID) від початкового рівня для загального показника I-QOL становила 8 балів на основі оцінки (MID) і приблизно складає від 4 до 11 балів для пацієнтів з нейрогенною гіперактивністю детрузора.
Середня тривалість реакції пацієнтів на препарат в обох базових дослідженнях, розрахована на основі вимоги пацієнтів на проведення повторного лікування, складала 256 - 295 днів (36 - 42 тижнів) для групи препарату БОТОКС® 200 одиниць - Аллерган і 92 дні (13 тижнів) для групи плацебо. Для усіх кінцевих показників ефективності у пацієнтів спостерігалося стале покращення під час повторного лікування. У базових дослідженнях у жодного, із загальної кількості 475 пацієнтів із нейрогенною гіперактивністю детрузора, не було виявлено нейтралізуючих антитіл.
Хронічна мігрень.
Препарат БОТОКС® блокує вивільнення нейротрансмітерів, пов’язаних із генезом болю. Механізм дії препарату БОТОКС® для послаблення симптомів хронічної мігрені до кінця не визначений. Доклінічні та клінічні фармакодинамічні дослідження припускають, що БОТОКС® пригнічує периферичну сенсибілізацію, таким чином можливо також уповільнює основну сенсибілізацію.
Основні результати, отримані з об’єднаного аналізу ефективності після двох курсів лікування препаратом БОТОКС®, введеного з інтервалом у 12 тижнів, виявлені у двох клінічних випробуваннях Фази 3 у пацієнтів із хронічною мігренню, які впродовж початкового 28-денного періоду мали щонайменше 4 епізоди та ≥ 15 днів головного болю (щонайменше 4 години безперервного головного болю) та щонайменше 50 % днів головного болю, що вважаються днями мігрені/ можливої мігрені), наведені в таблиці нижче:
|
Середня зміна від початкового рівня на тиждень 24 |
БОТОКС® Кількість – 688 |
Плацебо Кількість – 696 |
|
|
Кількість днів головного болю |
|
|
p<0,001 |
|
Кількість днів помірного/сильного головного болю |
|
|
p<0,001 |
|
Кількість днів мігрені/ можливої мігрені |
|
|
p<0,001 |
|
% пацієнтів із зменшенням на 50 % кількості днів головного болю |
47 % |
35 % |
p<0,001 |
|
Загальна сукупна кількість годин головного болю у дні головного болю |
|
|
p<0,001 |
|
Частота виникнення епізодів головного болю |
|
|
p<0,009 |
|
Загальні показники Тесту на вплив головного болю (HIT-6) |
|
|
p<0,001 |
Хоча дослідження не були спрямовані на визначення різниці у підгрупах, можна прослідкувати, що ефект від лікування був меншим у підгрупі пацієнтів чоловічої статі (кількість – 188) та не кавказького типу (кількість - 137), ніж у загальній популяції дослідження.
Первинний гіпергідроз пахвових западин.
Подвійне сліпе клінічне мультицентричне дослідження проводилося на пацієнтах із стійким двобічним первинним пахвовим гіпергідрозом, у яких, за даними гравіметричних вимірювань, у кожній пахві у спокійному стані мимоволі виділялося не менше 50 мг поту за 5 хв. при кімнатній температурі. Пацієнти були рандомізовані на дві групи, одна з яких отримувала 50 одиниць - Аллерган препарату, а друга – плацебо. Пацієнти продемонстрували зменшення пахвового потіння, порівняно з початковими даними, на 50 %. За 4 тижні після ін’єкції цей відсоток становив у групі, яка отримувала препарат, вже 93,8 % порівняно з групою плацебо, де цей відсоток становив 35,9 % (р <0,001). Відсоток респондентів у групі пацієнтів, якій вводили БОТОКС®, продовжував бути значно вищим (р <0,001), ніж у пацієнтів, які отримали плацебо, протягом усього періоду після лікування аж до 16 тижнів.
Подальше відкрите дослідження зареєструвало пацієнтів, які пройшли до 3 курсів лікування препаратом. Відсоток клінічної реакції на 16-ий тиждень після першого, другого та третього курсу лікування був відповідно 85 %, 86,2 % та 80 %. Середня тривалість ефекту, визначена на підставі комбінованого однодозового та відкритого тривалого випробування, становила 7,5 місяців після першого курсу, однак для 27,5 % пацієнтів тривалість ефекту становила 1 рік і більше.
Наявний невеликий досвід з клінічних випробувань відносно застосування препарату БОТОКС® у дітей з первинним гіпергідрозом пахвових западин віком від 12 до 18 років. Було проведено одноразове, однорічне, неконтрольоване, з повторюваною дозою випробування з безпеки у педіатричних пацієнтів в США, віком від 12 до 17 років (кількість - 144) з сильним первинним гіпергідрозом пахвових западин. Учасниками були переважно жінки (86,1 %) та пацієнти кавказького типу (82,6 %). Учасниці отримали лікування у дозі 50 одиниць - Аллерган у кожну пахвову западину з загальною дозою 100 одиниць - Аллерган за весь період лікування. Однак, ніяких випробувань щодо пошуку дози у підлітків не було проведено, таким чином ніяких рекомендацій щодо дозування не може бути надано. Ефективність та безпечність препарату БОТОКС® у даній групі не була остаточно встановлена.
Вертикальні зморшки між бровами (глабелярні зморшки).
Пацієнтам з вертикальними зморшками між бровами (глабелярними зморшками) (від помірно до значно виражених) при максимальному насупленні, які були включені до клінічного дослідження (кількість – 537), ін’єкції препарату значно зменшили вираженість глабелярних зморшок на термін до 4 місяців, що було визначено спеціальною оцінкою вираженості глабелярних зморшок при максимальному насупленні та загальною оцінкою суб’єктом змін зовнішнього вигляду його/її вертикальних зморшок між бровами (глабелярних зморшок). Жодні клінічні показники не включали об’єктивну оцінку психологічного впливу. Через 30 днів після ін’єкції 80 % пацієнтів, які пройшли лікування препаратом, були визначені як особи, що зреагували на лікування (повна відсутність або незначна вираженість при максимальному насупленні) порівняно з 3 % пацієнтів, які пройшли лікування плацебо. Одночасно 89 % пацієнтів, які пройшли лікування препаратом, відчули помірне або значне покращення порівняно з 7 % пацієнтів, які пройшли лікування плацебо.
Ін’єкції препарату БОТОКС® також значно зменшили вираженість глабелярних зморшок у стані спокою. 39 % пацієнтів мали від помірних до значних глабелярних зморшок у стані спокою (15 % не мали зморшок у стані спокою). З них 74 % пацієнтів, які пройшли лікування препаратом БОТОКС®, були визначені як особи, що зреагували на лікування (повна відсутність або незначна вираженість) через 30 днів після ін’єкції порівняно з 20 % пацієнтів, які пройшли лікування плацебо.
Наявні обмежені клінічні дані Фази 3 щодо застосування препарату БОТОКС® для пацієнтів, старших 65 років. Лише 6 % суб’єктів були старшими 65 років, та визначена ефективність була меншою для цієї вікової групи.
Фокальна спастичність нижніх кінцівок після перенесеного інсульту.
Було проведено 3-фазове подвійне сліпе, плацебо-контрольоване, рандомізоване, мультицентрове клінічне дослідження у дорослих пацієнтів після перенесеного інсульту зі спастичністю нижніх кінцівок, що вразила щиколотку. Загалом були вибірково відібрані 120 пацієнтів для введення препарату БОТОКС® (кількість=58) (загальна доза - 300 одиниць Аллерган) або плацебо (кількість=62). Це дослідження було проведене виключно за участю японців з показником ≥3 за Модифікованою шкалою Ешворта (MAS), у яких був інсульт за 6,5 років до проведення дослідження.
Значне покращення стану м’язів щиколотки за шкалою MAS в порівнянні з плацебо спостерігалося в первинній кінцевій точці порівняно з базовим рівнем, що розраховувалось з використанням площі під кривою (AUC). Значне середнє покращення стану м’язів щиколотки за шкалою MAS в порівнянні з плацебо також спостерігалося під час індивідуальних відвідувань після ін’єкції через 4, 6 і 8 тижнів. Частка респондентів (пацієнти з покращенням щонайменше на 1 пункт) також була значно більшою ніж у групі плацебо.
Препарат БОТОКС® був також пов'язаний зі значним покращенням функціональної недієздатності (вторинна кінцева точка, без регулювання кратності) за шкалою загального клінічного враження (CGI) порівняно з плацебо. Клінічно достовірне покращення за функціями та швидкістю ходи не було встановлено за шкалою оцінки лікаря (PRS).
Результати 3-фазового дослідження зазначені нижче.
Первинні та вторинні кінцеві точки дослідження ефективності
|
|
БОТОКС® (Кількість=58) |
Плацебо (Кількість=62) |
P-значення |
|
Середні показники AUC за шкалою MAS |
|
|
|
|
AUC (від 0 дня до 12 тижня) |
|
|
0,006 |
|
Середня зміна від базового рівня за шкалою MAS |
|
|
|
|
Базовий рівень |
3,28 |
3,24 |
|
|
1 тиждень |
|
|
0,222 |
|
4 тиждень |
|
|
< 0,001 |
|
6 тиждень |
|
|
< 0,001 |
|
8 тиждень |
|
|
< 0,001 |
|
12 тиждень |
|
|
0,240 |
|
Частка респондентів* |
|
|
|
|
1 тиждень |
52,6% |
38,7% |
0,128 |
|
4 тиждень |
67,9% |
30,6% |
< 0,001 |
|
6 тиждень |
68,4% |
36,1% |
< 0,001 |
|
8 тиждень |
66,7% |
32,8% |
< 0,001 |
|
12 тиждень |
44,4% |
34,4% |
0,272 |
*Пацієнти з покращення щонайменше на 1 пункт від базового рівня за шкалою MAS.
Спостерігалась стійка реакція на повторне введення препарату.
Зморшки у формі "гусячих лапок"
У дослідженні взяли участь 1362 пацієнта з помірною та тяжкою формою зморшок у формі "гусячих лапок" при широкій посмішці (кількість = 445, дослідження № 191622-098), або також з помірною та тяжкою формою глабелярних зморшок, при максимальному насупленні (кількість=917, дослідження № 191622-099).
Ін'єкції препарату БОТОКС® значно зменшили форму тяжкості зморшок у формі "гусячих лапок" при широкій посмішці в порівнянні з плацебо на всіх контрольних точках (р <0,001) на строк до 5 місяців. Це було визначено, використовуючи співвідношення пацієнтів, у яких зморшки були відсутні або були помірної тяжкості за шкалою оцінки вираженості зморшок у формі "гусячих лапок" при широкій посмішці при проведенні 2 базових досліджень; до 150 дня (завершення дослідження) у Дослідженні № 191622-098 та на 120 день (завершення першого циклу лікування в Дослідженні № 191622-099). Як при оцінці дослідником, так і пацієнтом, на базовому рівні співвідношення пацієнтів без зморшок або зморшок помірної тяжкості за шкалою оцінки вираженості зморшок у формі "гусячих лапок" при широкій посмішці було на користь пацієнтів з помірною тяжкістю зморшок у формі "гусячих лапок" при широкій посмішці, у порівнянні з пацієнтами з тяжкою формою зморшок у формі "гусячих лапок" при широкій посмішці. У таблиці 1 наведені результати на 30 день, первинна контрольна точка оцінки ефективності. У Дослідженні № 191622-104 (доповнення до Дослідження №191622-099), 101 пацієнт, попередньо відібраний в групу плацебо, був відібраний для першої ін’єкції у 44 одиниць-Аллерган. Пацієнти в групі введення БОТОКС® мали статистично достовірну перевагу на первинній контрольній точці оцінки ефективності в порівнянні з плацебо на 30 день після ін’єкції. Швидкість реакції була схожою в групі введення 44 одиниць-Аллерган на 30 день після першої ін’єкції в Дослідженні №191622-099. Всього 123 пацієнта пройшли 4 курси введення 44 одиниць-Аллерган БОТОКС® для комбінованого лікування зморшок у формі "гусячих лапок" та глабелярних зморшок.
Таблиця 1. 30-й день: Оцінка дослідником і пацієнтом зморшок у формі "гусячих лапок" при широкій посмішці – співвідношення респондентів (% пацієнтів без зморшок або з помірною тяжкістю зморшок у формі "гусячих лапок")
|
Клінічне дослідження |
Доза |
БОТОКС® |
Плацебо |
БОТОКС® |
Плацебо |
|
Оцінка дослідником |
Оцінка пацієнтом |
||||
|
191622-098 |
24 одиниці-Аллерган (зморшки у формі "гусячих лапок") |
66,7%* (148/222) |
6,7% (15/223) |
58,1%* (129/222) |
5,4% (12/223) |
|
191622-099 |
24 одиниці-Аллерган (зморшки у формі "гусячих лапок") |
54,9%* (168/306) |
3,3% (10/306) |
45,8%* (140/306) |
3,3% (10/306) |
|
44 одиниці-Аллерган (24 одиниці, зморшки у формі "гусячих лапок"; 20 одиниці-Аллерган, глабелярні зморшки) |
59,0%* (180/305) |
3,3% (10/306) |
48,5%* (148/305) |
3,3% (10/306) |
|
*p < 0.001 (БОТОКС® порівняно з плацебо)
Оцінка пацієнтами покращення вигляду зморшок у формі "гусячих лапок" при широкій посмішці в групі БОТОКС® (24 одиниці-Аллерган і 44 одиниці-Аллерган) від базового рівня у порівнянні з плацебо спостерігалось на 30 день, а також на всіх контрольних точках після кожного курсу лікування в обох базових дослідженнях (р <0,001).
Лікування за допомогою препарату БОТОКС® (24 одиниці-Аллерган) також значно послабило ступінь тяжкості зморшок у формі "гусячих лапок" в стані спокою. З 528 пацієнтів, 63% (330 з 528) пацієнтів мали помірну або тяжку ступінь зморшок у формі "гусячих лапок" в стані спокою на початку дослідження. З них у 58% (192 з 330) пацієнтів з групи БОТОКС® спостерігалась позитивна реакція на лікування (немає зморшок або помірної тяжкості) через тридцять днів після ін'єкції, у порівнянні з 11% (39 з 352) пацієнтів у групі плацебо.
За шкалою самостійної оцінки зморшок (FLO-11) на першій контрольній точці - 30 день (р<0,001) і на всіх наступних контрольних точках в обох базових дослідженнях, покращення самооцінки віку та привабливості також спостерігались в групі БОТОКС® (24 одиниці-Аллерган і 44 одиниці-Аллерган) у порівнянні з плацебо.
У базових дослідженнях 3,9% (53 з 1362) пацієнтів були старше 65 років. Реакція на лікування пацієнтів в цій віковій групі оцінювались дослідником, та спостерігалась у 36% (на 30-й день) пацієнтів в групі БОТОКС® (24 одиниці-Аллерган і 44 одиниці-Аллерган). При аналізі за віковими групами ≤50 років і >50 років, обидві групи продемонстрували статистично достовірне покращення в порівнянні з плацебо. Реакція на лікування в групі БОТОКС® 24 одиниць-Аллерган, за оцінкою дослідника, була меншою в групі пацієнтів >50 років, ніж у групі пацієнтів ≤50 років (42,0% і 71,2%, відповідно).
В цілому реакція на введення БОТОКС® для лікування зморшок у формі "гусячих лапок" при широкій посмішці була меншою (60%), ніж спостерігалось при лікуванні глабелярних зморшок при максимальному насупленні (80%).
У 916 пацієнтів (517 пацієнтів у групі введення 24 одиниць-Аллерган, і 399 пацієнтів у групі введення 44 одиниць-Аллерган), яким був введений БОТОКС®, були взяті зразки для аналізу на утворення антитіл. У жодного з пацієнтів не були виявлені нейтралізуючі антитіла.
Фармакокінетика.
а) Загальні властивості діючої речовини:
Дослідження розподілу, проведені на тваринах, показали повільну дифузію 125І-комплексу нейротоксину ботуліну А у литковий м’яз після ін’єкції, потім швидкий системний метаболізм та виділення із сечею. Кількість міченого ізотопом матеріалу у м’язі зменшувалася з періодом напіввиведення приблизно 10 годин. У місці ін’єкції радіоактивність була обмежена великими молекулами протеїну, а у плазмі – малими молекулами, що свідчить про швидкий системний метаболізм субстрату. Упродовж 24 годин після введення дози 60 % радіоактивності було виведено з сечею. Токсин, імовірно, метаболізується протеазами та молекулярними компонентами, які рециркулюють звичайними шляхами метаболізму.
Класичні дослідження абсорбції, розподілу, біотрансформації та виведення активної субстанції не проводилися через природу цього препарату.
б) Властивості при застосуванні у пацієнтів:
Вважається, що відбувається незначне системне поширення препарату БОТОКС® при застосуванні терапевтичних доз. Клінічні дослідження із використанням моноволоконної електроміографічної техніки показали збільшення електрофізіологічної нервово-м’язової активності у м’язах, віддалених від місця ін’єкції без будь-яких клінічних ознак або симптомів.
Клінічні характеристики.
Показания Ботокс пор. д/р-ра д/ин. 200 ЕД-Аллерган фл. №1
Препарат використовують:
для усунення м’язових спазмів:
- очної повіки (тонічний блефароспазм);
- обличчя (геміфаціальний спазм) та супроводжуюча фокальна дистонія;
- шиї та плечей (цервікальна дистонія);
- руки та зап’ястя у дорослих, які перенесли інсульт;
- для регулювання деформації стопи за типом кінської стопи у педіатричних пацієнтів, хворих на ДЦП, віком від 2-х років та старших;
- щиколотки у дорослих пацієнтів після перенесеного інсульту.
для лікування порушень функцій сечового міхура:
- ідіопатична гіперактивність сечового міхура з симптомами нетримання сечі, ургентного сечовипускання та підвищеної частоти сечовипускань у дорослих, які недостатньо реагують або не переносять антихолінергічні лікарські засоби;
- нетримання сечі у дорослих пацієнтів з нейрогенною гіперактивністю детрузора, в результаті нейрогенного сечового міхура, що є наслідком стійкого ушкодження суб-цервікального (шийного) відділу спинного мозку або розсіяного склерозу;
для лікування хронічної мігрені:
- симптоматичне полегшення у дорослих пацієнтів, стан яких може бути віднесений до хронічної мігрені (внаслідок виконання наступних критеріїв: головні болі ≥ 15 днів на місяць, з яких щонайменше 8 днів мігрені), які недостатньо реагують або не переносять профілактичні лікарські засоби для лікування мігрені. (див. розділ «Особливості застосування»);
для лікування та усунення:
- первинного гіпергідрозу пахвових западин, що перешкоджає роботі та не піддається місцевому лікуванню;
- вертикальних зморшок між бровами (від помірних до значно виражених) у дорослих віком до 65 років, коли різка вираженість цих зморшок має сильний психологічний вплив на пацієнта;
- помірної або тяжкої форми латеральних зморшок у кутку ока (зморшки у формі "гусячих лапок") при широкій посмішці;
- помірної або тяжкої форми зморшок у формі "гусячих лапок" при широкій посмішці та глабелярних зморшок при максимальному насупленні, при одночасному лікуванні.
Противопоказания Ботокс пор. д/р-ра д/ин. 200 ЕД-Аллерган фл. №1
Не використовувати БОТОКС® у пацієнтів:
- з гіперчутливістю до ботулінічного токсину типу А або будь-якого іншого компоненту препарату;
- з міастенією гравіс або синдромом Ітона Ламберта (для усунення вертикальних зморшок між бровами (глабелярні зморшки) у дітей віком до 18 років та пацієнтів похилого віку понад 65 років);
- з наявним інфекційним процесом у місці майбутньої ін’єкції.
При порушеннях функцій сечового міхура у пацієнтів:
- з наявною на момент лікування інфекцією сечовивідних шляхів;
- з гострою затримкою сечовиділення на момент лікування, які не застосовують катетеризацію на регулярній основі;
- у пацієнтів, які не хочуть та/або не в змозі ініціювати катетеризацію після лікування, якщо необхідно;
- з наявністю каменів у сечовому міхурі.
Особливі заходи безпеки
Слід вживати особливих заходів безпеки під час приготування та введення препарату, а також при інактивації та знищенні залишків невикористаного розчину.
У випадку інцидентів при роботі з лікарським засобом, незалежно від того, чи є він у вакуум-висушеному стані, чи відновлений, слід негайно вжити зазначених нижче відповідних заходів.
Токсин дуже чутливий до тепла та певних хімічних речовин.
Слід витерти будь-яку розлиту речовину: за допомогою абсорбенту, просоченого у розчині натрію гіпохлориду (розчин Жавеля), якщо розсипався вакуум-висушений продукт, або за допомогою сухого абсорбенту у випадку, якщо розлився розчин.
За допомогою абсорбенту, просоченого у розчині натрію гіпохлориду (розчин Жавеля), забруднені поверхні слід очистити, а потім висушити.
Якщо ампула розбилася, необхідно обережно зібрати уламки скла та витерти продукт, як зазначено вище, щоб не порізатися.
У випадку потрапляння препарату на шкіру, слід промити її розчином натрію гіпохлориду (розчин Жавеля), а потім вимити великою кількістю води.
У випадку потрапляння препарату в очі слід ретельно промити їх великою кількістю води.
При пораненні (порізі, уколі голкою) необхідно здійснити вищезазначені дії та отримати необхідну медичну допомогу залежно від отриманої дози.
Суворо дотримуйтеся цієї інструкції із застосування, експлуатації та утилізації медичного засобу!
Спеціальні заходи безпеки при поводженні з невикористаним лікарським засобом або відходами лікарського засобу.
Оскільки препарат БОТОКС® денатурується при утворенні бульбашок або при іншому сильному збовтуванні, вводьте розчинник у флакон обережно. Не використовуйте флакон, якщо вакуум не втягує розчинник в нього. Відновлений препарат БОТОКС® являє собою прозорий безбарвний або злегка жовтуватий розчин без сторонніх твердих часток. Перед застосуванням візуально перевірте розведений розчин на прозорість та відсутність часток. Відновлений у флаконі розчин препарату БОТОКС® може зберігатися до застосування у холодильнику (при температурі від 2 до 8 °С) протягом 24 годин. Якщо препарат БОТОКС® відновлюється у шприці для внутрішньоміхурового введення, розчин слід використати негайно.
Дані щодо дати та часу відновлення повинні бути нанесені на спеціальне місце на етикетці флакону. Цей препарат призначений тільки для одноразового використання. Будь-який невикористаний розчин повинен бути знищений.
Для безпечної утилізації невикористані флакони відновлюються невеликою кількістю води, а потім стерилізуються в автоклаві. Будь-які використані флакони, шприци, розлитий розчин тощо необхідно стерилізувати в автоклаві; залишки препарату БОТОКС® можуть деактивуватися за допомогою розведеного розчину гіпохлориту (0,5 %) протягом 5 хвилин.
Будь-який невикористаний препарат або відходи повинні утилізуватися згідно встановлених національних вимог.
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Не застосовувати разом з аміноглікозидними антибіотиками або спектиноміцином, або іншими медичними препаратами, що перешкоджають нервово-м’язовій передачі (наприклад, нервово-м’язовими блокаторами).
Ефект застосування різних серологічних типів нейротоксину ботуліна одночасно або з інтервалом у кілька місяців невідомий. Надмірна нервово-м’язова слабкість може бути посилена від застосування іншого токсину ботуліна до зникнення дії від попередньо застосованого ботулотоксину.
Вивчення взаємодії не проводилося. Про клінічно важливі взаємодії не повідомлялося.
Особливості застосування
Клінічні коливання під час повторного використання препарату БОТОКС® можуть бути результатом:
- способу, яким лікар проводить терапію;
- частоти проведення ін’єкції або задіяних для ін’єкції м’язів або ділянок шкіри;
- від невеликої різниці активності препарату БОТОКС® через те, яким способом виміряна активність кожного флакону;
- якщо ін’єкції проводять надто часто або доза надто велика, у пацієнта можуть з’явитися антитіла, які зменшуватимуть ефективність препарату БОТОКС®. Для обмеження такого ризику інтервали між двома курсами лікування мають становити не менше 3 місяців.
Не рекомендується застосування препарату БОТОКС® у пацієнтів:
- віком до 18, крім показання для регулювання деформації стопи за типом кінської стопи у педіатричних пацієнтів, хворих на ДЦП;
- віком старшим 65 років;
- які мали будь-які ускладнення після внутрішньом’язових ін’єкцій.
З обережністю застосовувати, якщо:
- наявні запалення м’язів або шкіри в зонах, куди лікар планує робити ін’єкції;
- пацієнт має значну слабкість або виснаження м’язів, у які лікар планує робити ін’єкції;
- пацієнт має дисфагію (складність при ковтанні) та утруднення ковтання в анамнезі;
- наявні докази нервово-м’язових захворювань (міастенія гравіс або синдром Ітона Ламберта);
- пацієнт має боковий аміотрофічний склероз або непериферійне нейром’язове захворювання;
- пацієнт має закритокутову глаукому;
- у минулому була операція або травма голови, шиї, ніг або грудної клітки;
- немає значного покращення стану здоров’я через місяць після першого курсу лікування.
Якщо перед проведенням терапії препаратом БОТОКС® пацієнт вів пасивний спосіб життя, то після ін’єкцій необхідно поступово збільшувати активність.
Послаблення визначеності вертикальних зморшок між бровами (глабелярних зморшок) загалом відбувається протягом одного тижня після завершення курсу лікування. Ефект зберігається до 4 місяців після ін’єкції.
Інтервали між лікуванням мають становити не менше 3 місяців. У разі відсутності ефективності лікування або зменшення ефекту після повторення ін’єкцій слід визначити інші методи лікування.
Цей препарат містить менше 1 ммоль натрію (23 мг) на дозу, тобто вважається таким, що «не містить натрію».
Відносна анатомія та будь-які зміни в ній через попередні хірургічні втручання необхідно зрозуміти до застосування препарату БОТОКС® та уникати ін’єкцій у вразливі анатомічні структури.
Серйозні побічні реакції, в тому числі летальні випадки, були зафіксовані у пацієнтів, яким вводили ін’єкції препарату БОТОКС® не за показаннями: безпосередньо в слинну залозу, орально-язично-глоточну ділянку, стравохід та шлунок. У деяких пацієнтів були попередньо дисфагія та значна слабкість.
Не перевищуйте рекомендовані дози та частоту застосування.
Дуже рідко можуть виникати анафілактичні реакції після введення ботулінічного токсину. У таких випадках слід застосувати епінефрин (адреналін) або інші засоби протишокової терапії.
Повідомляють про поодинокі випадки важких реакцій гіперчутливості негайного типу, включаючи анафілаксію, сироваткову хворобу, кропив’янку, набряк м’яких тканин та диспное. Про деякі з цих реакцій повідомлялося після застосування препарату БОТОКС® окремо або разом з іншими препаратами, пов’язаними з аналогічними реакціями. При виникненні такої реакції подальші ін’єкції препарату БОТОКС® треба відмінити та негайно застосувати відповідну лікувальну терапію, наприклад, епінефрином. Мав місце летальний випадок внаслідок анафілактичного шоку в результаті порушення інструкції по відновленню препарату БОТОКС®, при застосуванні в якості розчинника 5мл 1% розчину лідокаїну.
Зустрічалися також повідомлення про побічні дії, що стосуються розповсюдження токсину далеко від місця застосування, що інколи призводило до смерті, а у деяких випадках супроводжувалося дисфагією, пневмонією та/або помітним знесиллям.
Пацієнти, яких лікували терапевтичними дозами, можуть відчувати підвищену слабкість м’язів.
Пацієнти з перенесеними неврологічними порушеннями, включаючи утруднення ковтання, піддаються підвищеному ризику цих побічних дій. Для цих пацієнтів токсин ботуліну необхідно застосовувати під наглядом спеціаліста і тільки тоді, коли переваги від лікування значно перевищують ризик. Пацієнти з дисфагією та аспірацією в анамнезі повинні лікуватися особливо обережно.
Пацієнти або особи, що наглядають за ними, повинні знати, що в разі виникнення порушень ковтання, порушення функції мовлення або дихання необхідно негайно звернутися за медичною допомогою.
Про дисфагію також повідомляють після ін’єкцій не в цервікальну мускулатуру.
Клінічні відхилення під час повторного застосування препарату БОТОКС® (як і усіх токсинів ботуліну) можуть бути результатом різних процедур при розчиненні вмісту флакону, інтервалів між ін’єкціями, різних м’язів, у які вводиться препарат та незначної відмінності у значеннях активності, яку показав використаний метод біологічного тестування.
Поява антитіл, що нейтралізують токсин ботуліну типу А, може зменшити ефективність лікування препаратом БОТОКС® через інактивування біологічної активності токсину. Результати деяких досліджень свідчать, що ін’єкції препарату БОТОКС® через менші інтервали часу або у вищих дозах можуть призвести до більшої кількості випадків появи антитіл. При необхідності, можливість формування антитіл може бути мінімізована шляхом введення найменшої ефективної дози при найбільших клінічно показаних інтервалах між ін’єкціями.
Як і при будь-якому лікуванні, що дозволяє відновити активність малорухомих пацієнтів, таке відновлення у цій категорії пацієнтів повинне відбуватися поступово.
Слід з обережністю застосовувати препарат БОТОКС® при наявності запалення у місці майбутньої ін’єкцій або слабкості чи атрофії наміченого м’язу, при лікуванні пацієнтів з ураженням периферичних рухових нейронів (наприклад, з боковим аміотрофічним склерозом або руховою нейроропатією). Препарт БОТОКС® слід застосовувати з особливою обережністю та під пильним медичним наглядом у пацієнтів із субклінічними та клінічними ознаками порушеної нервово-м’язової передачі, наприклад, з міастенією гравіс або синдромом Ітона Ламберта. Такі пацієнти можуть мати підвищену чутливість до таких агентів, як БОТОКС®, що може призвести до надмірної слабкості м’язів. Пацієнти з нервово-м’язовими порушеннями можуть піддаватися підвищеному ризику клінічно виражених системних впливів, включаючи тяжку дисфагію та дихальну недостатність від звичайних доз препарату БОТОКС®.
Препарат БОТОКС® містить людський альбумін. Коли призначаються препарати, що містять продукти, виготовлені з людської крові чи плазми, не можна повністю виключати можливість передачі збудників інфекції. Щоб знизити ризик зараження інфекційними агентами, проводиться суворий контроль вибору донорів. Окрім того, під час виготовлення препаратів застосовується процедура деактивації вірусів.
Як і при будь-яких ін’єкціях, можуть виникнути травми, пов’язані безпосередньо з самою процедурою. Ін’єкція може призвести до локального інфікування, болю, запалення, парестезії, гіпостезії, болісності, припухлості, еритеми та/або кровотечі/синців. Біль, спричинений голкою, та/або страх можуть призвести до вазовагальних реакцій, наприклад, до втрати свідомості, артеріальної гіпотензії, синкопе. Слід з обережністю робити ін’єкції біля чутливих анатомічних структур.
Повідомлялося про пневмоторакс, пов’язаний з процедурою ін’єкції, після введення препарату БОТОКС® у ділянку біля торакса. З обережністю застосовувати поблизу легенів, особливо верхньої частини легенів.
Введення препарату не рекомендується у пацієнтів з історією захворювання на дисфагію та аспірацію.
При лікуванні глабелярних зморшок при максимальному насупленні або зморшок у формі "гусячих лапок" при широкій посмішці слід з обережністю застосовувати препарат для уникнення його введення в кровоносну судину.
Блефароспазм.
Зменшення кількості кліпань після ін’єкції токсину ботуліну в круговий м’яз ока біля очниці може призвести до впливу на рогівку, стійкого епітеліального дефекту, та виразки рогівки, особливо у пацієнтів з порушеннями функцій VII пари черепних нервів. Необхідно провести уважну перевірку чутливості рогівки в очах, що були оперовані, не робити ін’єкцій у зону нижньої повіки, щоб запобігти вивертанню (ектропіону) та добре обробити будь-який дефект епітелію. Це може призвести до необхідності застосування захисних крапель, мазей, терапевтичних м’яких контактних лінз або закриття очей пов’язкою.
Екхімоз дуже легко виникає у м’яких тканинах повіки. Його можна мінімізувати, злегка натиснувши на місце ін’єкції одразу ж після проведення процедури.
Через антихолінергічну дію токсину ботуліна потрібно з великою обережністю лікувати пацієнтів із наявним ризиком виникнення закритокутової глаукоми, включаючи пацієнтів з анатомічно вузьким кутом.
Цервікальна дистонія.
Пацієнти з цервікальною дистонією повинні бути поінформовані про можливість розвитку дисфагії, яка може бути дуже помірною або вираженою. Дисфагія може тривати 2 - 3 тижні після ін’єкції, однак є повідомлення і про її тривалість упродовж 5 місяців після ін’єкції. Після дисфагії може спостерігатися аспірація, диспное та необхідність зондового харчування. У поодиноких випадках повідомлялося про виникнення аспіраційної пневмонії внаслідок дисфагії, що спричинила летальний випадок.
Обмеження дози до 100 одиниць - Аллерган, що вводиться у грудинно-ключично-соскоподібний м’яз, може знизити ризик виникнення дисфагії. У пацієнтів із меншою масою шийного м’яза або пацієнтів, які отримували ін’єкції у грудинно-ключично-соскоподібний м’яз з обох боків, ризик виникнення дисфагії збільшується. Дисфагія пояснюється розповсюдженням токсину у мускулатуру стравоходу. Ін’єкції у м’яз, що піднімають лопатку, можуть бути пов’язані з підвищеним ризиком виникнення інфекції верхніх дихальних шляхів та дисфагії.
Дисфагія може спричинити зменшення надходження їжі та води і як наслідок – втрату маси тіла та зневоднення. Для пацієнтів із субклінічною дисфагією є підвищений ризик виникнення серйознішої дисфагії після ін’єкцій препарату БОТОКС®.
Фокальна спастичність, пов’язана з дитячим церебральним паралічем, спастичність руки та зап’ястка, а також щиколотки у дорослих пацієнтів після інсульту.
Лікування фокальної спастичності, яке знаходиться на стадії вивчення у звичайних стандартних схемах лікування і не призначене для заміни існуючих способів лікування, імовірно, не буде ефективним для покращення меж рухливості у суглобах, уражених контрактурою.
У постмаркетингових звітах дуже рідко повідомлялось про можливе розповсюдження токсину у педіатричних пацієнтів, які мали супутні захворювання, переважно у пацієнтів з церебральним паралічем. В основному, в таких випадках застосовувалась доза, що перевищувала рекомендовану.
Були рідкі спонтанні повідомлення про летальні випадки, інколи пов’язані із виникненням аспіраційної пневмонії у дітей із важкою формою церебрального паралічу після застосування ботулінічного токсину. Особливо обережно слід застосовувати препарат у лікуванні дітей з важкими формами неврологічних порушень, з дисфагією, а також у дітей, які нещодавно хворіли на аспіраційну пневмонію або мали захворювання легенів.
БОТОКС® слід застосовувати з обережністю для лікування фокальної спастичності щиколотки у пацієнтів похилого віку, що перенесли інсульт з важкими супутніми захворюваннями, а лікування слід починати тільки якщо користь від лікування переважає потенційний ризик.
БОТОКС® слід застосовувати для лікування спастичності нижніх кінцівок після перенесеного інсульту тільки після оцінки медичними працівниками з досвідом догляду і реабілітації хворих, що перенесли інсульт.
Препарат не слід застосовувати для лікування спастичності щиколотки у пацієнтів похилого віку, що перенесли інсульт, якщо зниження м’язового тонусу не призведе до покращення функції (наприклад, покращення ходи), або до покращення симптомів (наприклад, зменшення болю). Окрім того, покращення активної функції може бути обмеженим, якщо лікування препаратом почалося пізніше, ніж через 2 роки після інсульту у пацієнтів з низчою ступінню спастичності щиколотки.
Порушення функцій сечового міхура.
Необхідно провести відповідні застережні заходи при проведенні цистоскопії.
У пацієнтів, яким не застосовують катетеризацію, слід визначити залишковий об’єм сечі після сечовипускання впродовж 2 тижнів після лікування та періодично, якщо необхідно з медичної точки зору, впродовж 12 тижнів. Пацієнтів слід проінформувати про необхідність звернення до лікаря, якщо вони відчувають ускладнення при сечовипусканні, оскільки у цьому випадку може бути необхідна катетеризація.
Ідіопатична гіперактивність сечового міхура.
Чоловікам із гіперактивним сечовим міхуром та ознаками або симптомами непрохідності сечовивідних каналів не слід застосовувати БОТОКС® для лікування.
Нетримання сечі в результаті нейрогенної гіперактивності детрузора.
Можливе виникнення автономної дизрефлексії, пов’язаної з процедурою. Може знадобитись невідкладна медична допомога.
Хронічна мігрень.
Безпека та ефективність препарату БОТОКС® не вивчались для профілактики головного болю у пацієнтів з епізодичними проявами мігрені (головні болі < 15 днів на місяць) або хронічним головним болем напруги.
Безпека та ефективність препарату БОТОКС® у пацієнтів з головним болем, викликаним надмірним споживанням лікарських засобів (розлад вторинного головного болю), не вивчались.
Первинний гіпергідроз пахвових западин.
Вивчення анамнезу, обстеження та спеціальні додаткові дослідження – все це необхідне, щоб виключити потенційні причини вторинного гіпергідрозу (наприклад, гіпертиреозу, феохромоцитоми). Це дозволить запобігти симптоматичному лікуванню гіпергідрозу без діагностування та/або лікування хвороби, що його спричинила.
Вертикальні зморшки між бровами (глабелярні зморшки).
Окрема упаковка може застосовуватися для лікування лише одного пацієнта впродовж одного курсу. Надлишок невикористаного продукту має бути утилізований.
Слід вживати особливих застережних заходів при підготовці та введенні продукту, а також при деактивації та утилізації невикористаного розчину.
Ін’єкція препарату БОТОКС® для усунення глабелярних зморшок не рекомендується пацієнтам із дисфагією та аспірацією в анамнезі.
Застосування препарату не рекомендується особам віком до 18 років та пацієнтам, старшим 65 років.
Здатність впливати на швидкість реакції при керуванні автотранспортом або роботи з іншими механізмами.
Досліджень щодо впливу препарату БОТОКС® на швидкість реакції при керуванні автотранспортом або роботи з іншими механізмами не проводилось. Слід звертати увагу водіїв автомашин та операторів механізмів на потенційні ризики астенії, слабкості м’язів, запаморочення та порушення зору, пов’язані із застосуванням цього медичного препарату, що можуть зробити керування автомашинами або експлуатацію механізмів небезпечними.
Несумісність
Оскільки вивчення сумісності не проводилося, цей препарат не слід змішувати з іншими медичними препаратами.
Способ применения и дозы Ботокс пор. д/р-ра д/ин. 200 ЕД-Аллерган фл. №1
Одиниці токсину ботуліну одного препарату не є взаємозамінними з одиницями іншого препарату. Дози, рекомендовані в одиницях-Аллерган, є відмінними від інших ботулотоксичних препаратів.
Пацієнти літнього віку .
Спеціальна корекція дози не потрібна у разі застосування пацієнтам літнього віку. Початкова доза препарату повинна бути мінімальною рекомендованою дозою для конкретного показання. Для повторних ін’єкцій рекомендується найнижча ефективна доза з якомога більшим клінічним інтервалом між ін’єкціями. З обережністю застосовувати пацієнтам літнього віку з тяжкими захворюваннями в анамнезі та пацієнтам, які приймають супутні лікарські засоби. Наявні обмежені дані щодо застосування препарату БОТОКС® для лікування пацієнтів віком понад 65 років з нетриманням сечі внаслідок нейрогенної гіперактивності детрузора, з порушенням функції щиколотки та стопи внаслідок спастичності нижніх кінцівок, пов’язаної з перенесеним інсультом, та для лікування зморшок на обличчі.
Якщо флакони БОТОКС® різного об’єму використовуються в одній терапевтичній процедурі, слід ретельно відбирати необхідну кількість розчинника при відновленні певної кількості одиниць препарату на 0,1 мл. Кількість розчинника варіюється для 100 одиниць-Аллерган та 200 одиниць-Аллерган. Кожний шприц необхідно відповідним чином маркувати.
БОТОКС® необхідно відновлювати тільки стерильним фізіологічним розчином без консервантів (0,9% натрію хлориду для ін’єкцій). Відповідну кількість розчинника (див. таблицю 10) необхідно набрати шприцом.
Таблиця 10
Відновлення препарату БОТОКС®, 100 одиниць-Аллерган та 200 одиниць-Аллерган, для всіх показань за виключенням порушення функції сечового міхура
|
Отримана доза (одиниць-Аллерган на 0,1 мл) |
Кількість розчинника (0,9 % натрію хлориду для ін’єкцій), що додається до флакону |
|
|
100 одиниць-Аллерган |
200 одиниць-Аллерган |
|
|
20 одиниць-Аллерган |
0,5 мл |
1 мл |
|
10 одиниць-Аллерган |
1 мл |
2 мл |
|
5 одиниць-Аллерган |
2 мл |
4 мл |
|
4 одиниць-Аллерган |
2,5 мл |
5 мл |
|
2,5 одиниць-Аллерган |
4 мл |
8 мл |
|
1,25 одиниць-Аллерган |
8 мл |
Не застосовується |
Ідіопатична гіперактивність сечового міхура
Рекомендується використовувати флакон по 100 одиниць -Аллерган для зручності відновлення.
Для 100 одиниць-Аллерган
· Відновіть один флакон препарату БОТОКС®, 100 одиниць-Аллерган, за допомогою 10 мл 0,9% розчину натрію хлориду для ін’єкцій без консервантів та обережно перемішайте.
· Перенесіть 10 мл з флакона у шприц ємністю 10 мл.
В результаті буде отримано шприц ємністю 10 мл із загальною кількістю відновленого препарату БОТОКС®, 100 одиниць-Аллерган. Використати негайно після відновлення в шприці. Невикористаний розчин потрібно утилізувати.
Для 200 одиниць-Аллерган
· Відновіть один флакон препарату БОТОКС®, 200 одиниць-Аллерган, за допомогою 8 мл 0,9 % розчину натрію хлориду для ін’єкцій без консервантів та обережно перемішайте.
· Перенесіть 4 мл з флакона у шприц ємністю 10 мл.
· Закінчіть відновлення, додавши 6 мл 0,9% розчину натрію хлориду для ін’єкцій без консервантів до шприца ємністю 10 мл, і обережно перемішайте.
В результаті буде отримано шприц ємністю 10 мл із загальною кількістю відновленого препарату БОТОКС®, 100 одиниць-Аллерган. Використати негайно після відновлення в шприці. Невикористаний розчин потрібно утилізувати.
Нетримання сечі внаслідок нейрогенної гіперактивності детрузора
Рекомендується використовувати флакон по 200 одиниць -Аллерган або два флакон и по 100 одиниць -Аллерган для зручності відновлення.
Для 100 одиниць-Аллерган
· Відновіть два флакони препарату БОТОКС®, 100 одиниць-Аллерган, кожний за допомогою 6 мл 0,9% розчину натрію хлориду для ін’єкцій без консервантів, та обережно перемішайте.
· Перенесіть 4 мл з кожного флакона до кожного з двох шприців ємністю 10 мл.
· Залишок по 2 мл з кожного флакона перенесіть до третього шприца ємністю 10 мл.
· Закінчіть відновлення, додавши 6 мл 0,9% розчину натрію хлориду для ін’єкцій без консервантів до кожного зі шприців ємністю 10 мл, і обережно перемішайте.
В результаті буде отримано 3 шприци, кожен ємністю 10 мл, із загальною кількістю відновленого препарату БОТОКС®, 200 одиниць-Аллерган. Використати негайно після відновлення у шприці. Невикористаний розчин потрібно утилізувати.
Для 200 одиниць-Аллерган
· Відновіть 200 одиниць-Аллерган препарату БОТОКС® за допомогою 6 мл 0,9% розчину натрію хлориду для ін’єкцій без консервантів та обережно перемішайте.
· Перенесіть 2 мл з флакона до кожного з трьох шприців ємністю 10 мл.
· Закінчіть відновлення, додавши 8 мл 0,9% розчину натрію хлориду для ін’єкцій без консервантів до кожного зі шприців ємністю 10 мл, і обережно перемішайте.
В результаті буде отримано 3 шприци, кожен ємністю 10 мл, із загальною кількістю відновленого препарату БОТОКС®, 200 одиниць-Аллерган. Використати негайно після відновлення у шприці. Невикористаний розчин потрібно утилізувати.
Ознайомтесь з докладною інструкцією щодо застосування для кожного з показань, зазначених нижче.
БОТОКС® повинен вводити тільки лікар відповідної кваліфікації, який має відповідний досвід лікування і використовує під час лікування відповідне обладнання.
Загалом оптимальна доза та кількість ін’єкцій на один м’яз не визначені для всіх показань, тому індивідуальну терапевтичну дозу має визначати лікар. Оптимальну дозу визначають методом титрування, але рекомендовану максимальну дозу не слід перевищувати.
НЕВРОЛОГІЧНІ ЗАХВОРЮВАННЯ
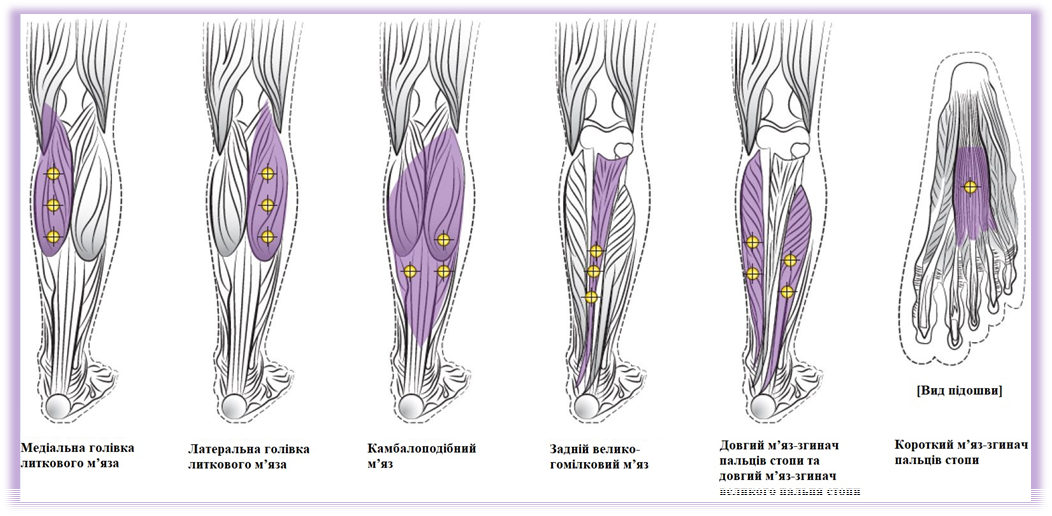
Фокальна спастичність , пов’язана з дитячим церебральним паралічем
|
Рекомендована голка |
Стерильна голка калібру 23-26/0,60-0,45 мм. |
|
Інструкція і з застосування |
Застосовується у вигляді розподіленої на курс лікування загальної дози, що вводиться окремими ін’єкціями у центральну та бокові верхні частини ураженого литкового м’яза. |
|
Рекомендована доза |
При геміплегії: початкова рекомендована доза становить 4 одиниці-Аллерган на 1 кг маси тіла у вражену кінцівку. При диплегії: початкова рекомендована доза становить 6 одиниць-Аллерган на 1 кг маси тіла, розділена між враженими кінцівками. |
|
Максимальна загальна доза |
200 одиниць-Аллерган або 6,0 одиниць-Аллерган/кг маси тіла залежно від того, яка із зазаначених доз є меншою. Лікарський засіб вводять із 3-місячним інтервалом. |
|
Додаткова інформація |
Клінічне покращення, як правило, з’являється упродовж перших 2 тижнів після ін’єкції. Повторні дози потрібно застосовувати при зменшенні ефекту попередніх ін’єкцій, але не частіше ніж кожні 3 місяці. Для дітей слід підбирати таку дозу, яка дасть змогу робити перерви між ін’єкціями тривалістю не менше 6 місяців. |
Фокальна спастичність верхніх кінцівок після перенесеного інсульту.
|
Рекомендована голка |
Стерильна голка калібру 25, 27 або 30. Довжину голки слід обирати залежно від місцерозташування м’яза та його глибини. |
||||||||||||||
|
Інструкція з застосування |
Для локалізації залученого м’яза можна використовувати методику нейростимуляції або електроміографію. Різні місця ін’єкцій дають змогу препарату БОТОКС® мати більший вплив на зони іннервації, що особливо важливо для більших м’язів. |
||||||||||||||
|
Рекомендована доза |
Точну дозу і кількість місць для ін’єкцій необхідно коригувати залежно від індивідуальних розмірів, кількості і локалізації залучених м’язів, тяжкості спастичності, наявності локальної м’язової слабкості та індивідуальної відповіді пацієнта на попереднє лікування. Таблиця 11 Дози, які застосовували при проведенні контрольованих клінічних досліджень
|
||||||||||||||
|
|
|
||||||||||||||
|
Максимальна загальна доза |
200-240 одиниць-Аллерган. Дозу розділяють та вводять у визначені м’язи. |
||||||||||||||
|
Додаткова інформація |
При проведенні контрольованих клінічних досліджень пацієнти обстежувались впродовж 12 тижнів після одиничної ін’єкції. Покращення м’язового тонусу з’явилося упродовж двох тижнів, а максимальний ефект, як правило, спостерігався упродовж 4-6 тижнів. При проведенні відкритого неконтрольованого клінічного дослідження більшість пацієнтів отримували повторну ін’єкцію з інтервалом 12-16 тижнів, коли ефект на тонус м’яза зменшується. Цим пацієнтам вводили до 4 ін’єкцій з максимальною кумулятивною дозою 960 одиниць-Аллерган впродовж 54 тижнів. На розсуд лікаря повторну дозу можна призначати, коли ефект від попередньої ін’єкції зменшується. Ступінь і характер м’язової спастичності під час повторної ін’єкції може бути причиною зміни дози препарату і вибору м’яза для ін’єкції. Потрібно застосовувати найменшу ефективну дозу. |
Фокальна спастичність нижніх кінцівок, пов’язана з перенесеним інсультом.
|
Рекомендована голка |
Стерильна голка калібру 25, 27 або 30. Довжину голки потрібно обирати залежно від місцерозташування м’язу та його глибини. |
||||||||||||||
|
Інструкція з застосування |
Корисною може бути локалізація залученого м’яза з використанням методики нейростимуляції або електроміографії або ультразвуку. Більша кількість місць введення дає змогу препарату БОТОКС® мати більший вплив на зони іннервації, що особливо важливо для більших м’язів.
Нижче наведено діаграму з місцями для ін’єкцій при лікуванні спастичності нижніх кінцівок у дорослих. |
||||||||||||||
|
|
|||||||||||||||
|
Рекомендована доза |
300 - 400 одиниць-Аллерган, розділених на 6 м’язів, як зазначено в таблиці 12. Таблиця 12 Дозування препарату БОТОКС® при лікуванні спастичності нижніх кінцівок у дорослих
|
||||||||||||||
|
Максимальна доза |
400 одиниць-Аллерган загально. |
||||||||||||||
|
Додаткова інформація |
Лікар може вважати за необхідне проведення повторної ін’єкції, коли клінічний ефект попередньої ін’єкції зменшився, але повторну ін’єкцію слід здійснювати не раніше ніж через 12 тижнів після попередньої ін’єкції. |
||||||||||||||
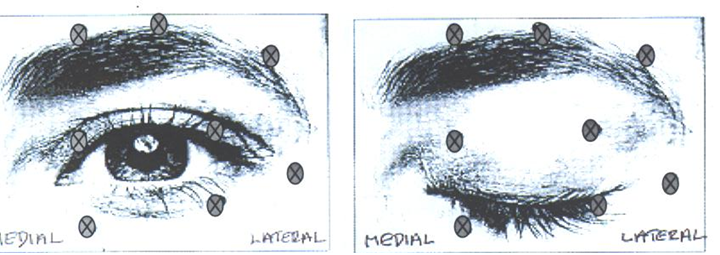
Блефароспазм / геміфаціальний спазм
|
Рекомендована голка |
Стерильна голка калібру 27-30/0,40-0,30 мм. |
|
Інструкція і з застосування |
Електроміографічне дослідження не потрібне. |
|
Рекомендована доза |
Початкову рекомендовану дозу 1,25-2,5 одиниць-Аллерган вводять в середню та бокову частинуorbicularis oculi верхньої повіки та у бокову частинуorbicularis oculi нижньої повіки. Можна вводити препарат і в додаткові зони - зону брів, бокову частину кругового м’яза та у верхню ділянку обличчя, якщо спазми в них заважають виконувати зорові функції. |
|
Максимальна загальна доза |
Початкова доза не має перевищувати 25 одиниць-Аллерган на одну очну зону. При регулюванні блефароспазму загальна доза не повинна перевищувати 100 одиниць-Аллерган кожні 12 тижнів. |
|
Додаткова інформація |
Щоб зменшити ризик такого ускладнення, як птоз (опущення), не допускаються ін’єкції біля м’яза, що піднімає верхню повіку. А щоб зменшити ризик такого ускладнення, як диплопія (двоїння в очах), не допускаються ін’єкції у середню частину нижньої повіки.
На рисунку 1 показано можливі зони ін’єкції. |
|
Рис. 1 |
|
|
|
Первинний ефект від ін’єкцій можна побачити через 3 дні, а максимальний досягається за перші 2 тижні після процедури. Ефект від кожної процедури діє приблизно 3 місяці, після чого у разі необхідності її можна повторити. При повторних сеансах дозу можна збільшити майже вдвічі, якщо результат після першої процедури недостатній. |
|
|
Однак доведено, що немає переваг при введенні понад 5 одиниць-Аллерган в одну зону. Немає жодних додаткових переваг при застосуванні частіше, ніж кожні 3 місяці. Пацієнти з геміфаціальним спазмом або порушеннями функцій VII пари черепних нервів повинні лікуватися як пацієнти з однобічним блефароспазмом, за необхідності можна вводити препарат в інші уражені м’язи (наприклад, м’язиzygomaticus major , orbicularis oris). |
Спастичність м язів шиї та плечей у дорослих ( цервікальна дистонія ).
|
Рекомендована голка |
Голки відповідного калібру (зазвичай 25-30/0,50-0,30 мм). |
|
Інструкція і з застосування |
В клінічних дослідження лікування цервікальної дистонії зазвичай здійснювалось за допомогою введення препарату БОТОКС® в такі м’язи: груднино-ключично-соскоподібний (sternocleidomastoid); м’яз, що піднімає лопатку (levator scapulae); сходовий (scalene); ремінний м’яз голови (splenius capitis); напівостистий (semispinalis); найдовший (longissimus) та/або трапецієподібний (trapezius). Цей список не є вичерпним, оскільки будь-який із м’язів, відповідальних за контроль положення голови, може бути ушкоджений і тому вимагатиме лікування. М’язова маса і ступінь гіпертрофії або атрофії є факторами, які необхідно брати до уваги при виборі відповідної дози. Модель активації м’язів може спонтанно змінюватись при цервікальній дистонії без зміни клінічної картини дистонії. У разі будь-яких ускладнень відносно виокремлення певних м’язів, ін’єкції потрібно здійснювати за допомогою електроміографії. |
|
Рекомендована доза |
При первинному курсі терапії загальна доза не повинна перевищувати 200 одиниць-Аллерган, при подальших курсах дозу коригують залежно від первинного результату. При проведенні перших контрольованих клінічних досліджень для визначення безпеки та ефективності при лікуванні цервікальної дистонії дози відновленого препарату БОТОКС® становили від 140 до 280 одиниць-Аллерган. При проведенні більш пізніх досліджень дози варіювалися від 95 до 360 одиниць-Аллерган (із середньою дозою приблизно 240 одиниць-Аллерган). Як і у разі застосування будь-якого іншого лікарського засобу, початкова доза у пацієнта, якому раніше не вводився препарат, має становити мінімальну ефективну дозу. Не більше 50 одиниць-Аллерган препарату в кожну окрему ділянку. Не більше 100 одиниць-Аллерган в груднино-соскоподібний м’яз (sternomastoid). Для мінімізації випадків дисфагії грудино-соскоподібний м’яз не слід обколювати з двох сторін. |
|
Максимальна загальна доза |
Загальна доза введення препарату за один сеанс не повинна перевищувати 300 одиниць-Аллерган. Інтервали лікування, менші, ніж 10 тижнів, не рекомендуються. |
|
Додаткова інформація |
Клінічне покращення зазвичай спостерігається впродовж перших 2 тижнів після ін’єкції. Максимальний позитивний клінічний результат зазвичай спостерігається через 6 тижнів після ін’єкції. Тривалість позитивного клінічного результату, зареєстрованого в клінічних дослідженнях, суттєво відрізнялась в кожному окремому випадку (від 2 до 33 тижнів), а середня тривалість становила 12 тижнів. |
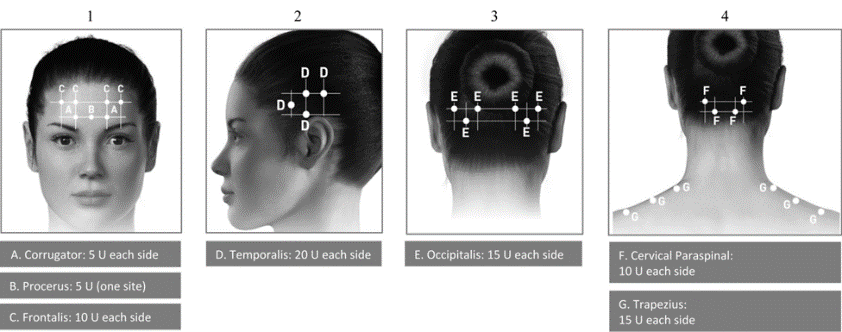
Хронічна мігрень .
|
Рекомендована голка |
Стерильна голка калібру 30/0,30 мм. |
||||||||||||||||||
|
Інструкція і з застосування: |
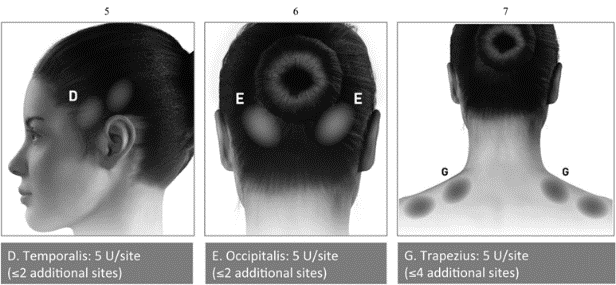
Ін’єкції слід вводити в 7 специфічних зон м’язів голови та шиї, як зазначено на рисунку 2 та у таблиці 11. Для шийної зони пацієнтам із дуже товстими шийними м’язами може бути потрібна голка калібру 25/0,50 мм. У м’яз гордіїв (procerus) ін’єкцію потрібно вводити в одну ділянку (лінія середини), у всі інші м’язи слід вводити двостороннім способом: половину кількості ін’єкцій у ділянки в лівій стороні і половину - в правій стороні голови та шиї. Якщо наявна ділянка/-ки основної локалізації болю, можна ввести додаткові ін’єкції з однієї або обох сторін у 3 специфічні групи м’язів:occipitalis , temporalisтаtrapezius. Максимальна доза на один м’яз зазначена в таблиці 12. На рисунку 2 показано ділянки для ін’єкцій. |
||||||||||||||||||
|
Рис. 2 На рисунку 2а вказано рекомендовані групи м’язів для здійснення опціональних додаткових ін’єкцій.
Рис. 2а |
|||||||||||||||||||
|
Рекомендована доза |
Від 155 до 195 одиниць-Аллерган, які вводяться внутрішньом’язово по 0,1 мл (5 одиниць-Аллерган) у 31-39 ділянок. Таблиця 13 Дозування препарату БОТОКС® для лікування хронічної мігрені за видами м’язів
a 1 Доза для внутрішньом’язової ін’єкції в одну ділянку становить 0,1 мл, що дорівнює 5 одиниць-Аллерган препарату БОТОКС®. b Доза, введена двостороннім способом. |
||||||||||||||||||
|
Додаткова інформація |
Рекомендований режим лікування становить - 12 тижнів.
|
||||||||||||||||||
ПОРУШЕННЯ ФУНКЦІЇ СЕЧОВОГО МІХУРА
На момент лікування у пацієнтів не повинно бути інфекції сечовивідних шляхів.
З метою профілактики слід застосовувати антибіотики: 1-3 дні до початку лікування, у день лікування та 1-3 дні після лікування.
Пацієнтам рекомендується припинити антитромбоцитарну терапію щонайменше за 3 дні до проведення процедури. Пацієнти, які отримують антикоагулянтну терапію, повинні перебувати під належним медичним наглядом, щоб зменшити ризик появи кровотечі.
Для лікування нетримання сечі БОТОКС® має вводити лікар, який має відповідний досвід у діагностиці та лікуванні порушень функції сечового міхура (наприклад уролог, урогінеколог).
Ідіопатична гіперактивність сечового міхура .
|
Рекомендована голка |
Можна використовувати гнучкий або зафіксований (ригідний) цистоскоп. Ін’єкційну голку слід наповнити (промити) приблизно 1 мл відновленого препарату БОТОКС® перед початком проведення ін’єкцій (залежно від довжини голки), щоб витіснити повітря. |
|
Інструкція і з застосування: |
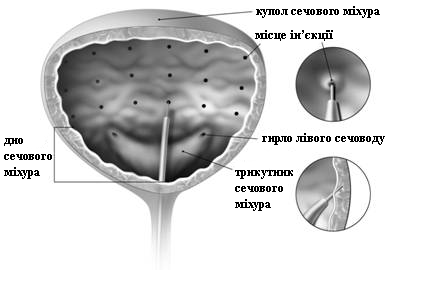
Перед ін’єкцією можливе внутрішньоміхурове введення розчиненого знеболюючого засобу (із заспокійливим або без нього) за локалізацією залученої ділянки. Якщо застосовується місцева анестезія, то слід провести дренування сечового міхура та його промивання за допомогою стерильного розчину натрію хлориду перед тим, як продовжувати процедуру. Відновлений препарат БОТОКС® (100 одиниць-Аллерган/10 мл) вводиться у м’яз детрузора за допомогою гнучкого або зафіксованого (ригідного) цистоскопу, уникаючи трикутника та дна сечового міхура (див. рис. 3). У сечовий міхур слід ввести достатню кількість розчину натрію хлориду, щоб досягти достатньої візуалізації для ін’єкцій, але слід уникати надмірного розтягнення сечового міхура. Голку слід вводити приблизно на 2 мм у детрузор. Вводять 20 ін’єкцій, кожна по 0,5 мл (загальний об’єм 10 мл), на відстані приблизно 1 см одна від одної (див. рис. 3). В останній ін’єкції слід ввести приблизно 1 мл стерильного розчину натрію хлориду, щоб забезпечити повне дозування. Після введення ін’єкцій розчин натрію хлориду, використаний для візуалізації стінки сечового міхура, не слід дренувати, допоки у пацієнтів не буде можливості випорожнення перед тим, як залишити лікувальний заклад. Слід наглядати за пацієнтом щонайменше 30 хвилин після введення ін’єкцій, допоки наявні спонтанні випорожнення.
Рис. 3. |
|
Рекомендована доза |
Рекомендована доза становить 100 одиниць-Аллерган препарату БОТОКС®, по 0,5 мл ін’єкції (5 одиниць-Аллерган) у 20 ділянок детрузора. |
|
Додаткова інформація |
Клінічне покращення може спостерігатись впродовж 2 тижнів. Пацієнтам слід зробити повторну ін’єкцію, якщо клінічний ефект від попередньої ін’єкції зменшився (під час клінічних досліджень фази 3 середня тривалість ефекту становила 166 днів [~24 тижні] на основі вимоги пацієнтів на проведення повторного лікування), але не раніше ніж через 3 місяці після попереднього введення. |
Нетримання сечі внаслідок нейрогенної гіперактивності детрузора .
|
Рекомендована голка |
Можна використовувати гнучкий або зафіксований (ригідний) цистоскоп. Ін’єкційну голку слід наповнити (промити) приблизно 1 мл відновленого препарату БОТОКС® перед початком проведення ін’єкцій (залежно від довжини голки), щоб витіснити повітря. |
|
Інструкція і з застосування |
Перед ін’єкцією можливе внутрішньоміхурове введення розчиненого знеболюючого засобу (із заспокійливим або без нього) або застосування загальної анестезії, місцевої анестезії за локалізацією залученої ділянки. Якщо застосовується місцева анестезія за локалізацією залученої ділянки, то слід провести дренування сечового міхура та його промивання за допомогою стерильного розчину натрію хлориду перед тим, як продовжувати процедуру ведення ін’єкції. Відновлений препарат БОТОКС® (200 одиниць-Аллерган/30 мл) вводиться у м’яз детрузора за допомогою гнучкого або зафіксованого (ригідного) цистоскопу, уникаючи зони трикутника та дна сечового міхура. У сечовий міхур слід ввести достатню кількість розчину натрію хлориду, з метою достатньої візуалізації, але слід уникати надмірного розтягнення сечового міхура. Голку слід вводити приблизно на 2 мм у детрузор. Проводять 30 ін’єкцій, кожна по 1 мл (загальний об’єм 30 мл), на відстані приблизно 1 см одна від одної (див. рис. 3). В останній ін’єкції слід ввести приблизно 1 мл стерильного розчину натрію хлориду, щоб забезпечити повне дозування. Після введення ін’єкцій розчин натрію хлориду, використаний для візуалізації стінки сечового міхура, слід дренувати. Слід спостерігати за пацієнтом щонайменше 30 хвилин після введення ін’єкцій. |
|
Рекомендована доза |
Рекомендована доза становить 200 одиниць-Аллерган препарату БОТОКС®, по 1 мл ін’єкції (~6,7 одиниць-Аллерган) паралельно у 30 ділянок детрузора. |
|
Додаткова інформація |
Клінічне покращення зазвичай може бути зареєстроване впродовж 2 тижнів. Пацієнтам слід зробити повторну ін’єкцію, якщо клінічний ефект від попередньої ін’єкції зменшився (під час клінічних досліджень фази 3 середня тривалість ефекту становила 256-295 днів (~36-42) при застосуванні препарату БОТОКС® 200 одиниць-Аллерган на основі вимоги пацієнтів на проведення повторного лікування), але не раніше ніж через 3 місяці після попереднього введення. |
РОЗЛАДИ ШКІРИ ТА ПІДШКІРНОЇ КЛІТКОВИНИ
Первинний гіпергідроз пахвових западин.
|
Рекомендована голка |
Стерильна голка калібру 30/0,30 мм. |
|
Інструкція і з застосування |
Зона максимального потовиділення може бути визначена за допомогою техніки фарбування, наприклад йодо-крохмальний тест. |
|
Рекомендована доза |
50 одиниць-Аллерган препарату вводять підшкірно, розподіляючи їх по багатьох точках ділянки на відстані приблизно 1-2 см одна від одної в зоні максимального потовиділення кожної підпахвової западини. |
|
Максимальна загальна доза |
Не рекомендується вводити дозу понад 50 одиниць-Аллерган на одну пахвову западину. Ін’єкції не слід повторювати частіше, ніж кожні 16 тижнів |
|
Додаткова інформація |
Клінічне покращення зазвичай може спостерігатися впродовж першого тижня після ін’єкції. Повторну ін’єкцію препарату БОТОКС® можна здійснювати тоді, коли клінічний ефект попередньої ін’єкції зменшився та на думку лікаря повторна ін’єкція є необхідною. |
Вертикальні зморшки між бровами ( глабелярні зморшки ).
|
Рекомендована голка |
Стерильна голка калібру 30/0,30 мм. |
|
Інструкція і з застосування |
Перед введенням ін’єкції слід міцно притиснути великий або вказівний палець нижче орбітального краю, щоб запобігти екстравазації. Голку слід спрямовувати зверху та посередині. Крім того, не допускаються ін’єкції біля м’яза, що піднімає верхню повіку (levator palpebrae superioris), особливо у пацієнтів з більшим комплексом бровного депресора (depressor supercilii). Ін’єкції у м’яз, що викликає зморщування шкіри (corrugator), слід вводити у центральну частину м’яза, щонайменше на 1 см вище дуг брів (див. рис. 4). З обережністю вводити у зону вертикальних зморщок між бровами (глабелярних зморщок при максимальному насупленні), щоб уникнути попадання у кровоносні судини.
Рис. 4 |
|
Рекомендована доза |
Вводять ін’єкцію об’ємом 0,1 мл (4 одиниці-Аллерган) у кожну з п’яти ділянок для ін’єкцій (див. рис. 4): 2 ін’єкції у кожний м’яз, що викликає зморщування шкіри (corrugator), та 1 ін’єкція у м’яз гордіїв (procerus), щоб загальна доза становила 20 одиниць-Аллерган. |
|
Максимальна загальна доза |
Для зменшення ризику птозу повіки не слід перевищувати максимальну дозу 4 одиниці-Аллерган на одну ділянку, а також кількість ділянок для ін’єкцій. |
|
Додаткова інформація |
Зменшення вираженості зморщок між бровами при максимальному насупленні зазвичай спостерігається через один тиждень після лікування, ефект триває до 4 місяців. Лікування можна повторювати не частіше ніж кожні 3 місяці. У разі неефективного лікування або зменшення ефекту після повторних ін’єкцій можна застосовувати альтернативні методи лікування. У разі неефективності введеної дози препарату БОТОКС® повторні введення препарату можуть бути застосовані та збільшена загальна доза до 40-50 одиниць-Аллерган, враховуючи аналіз попередніх невдалих введень препарату. |
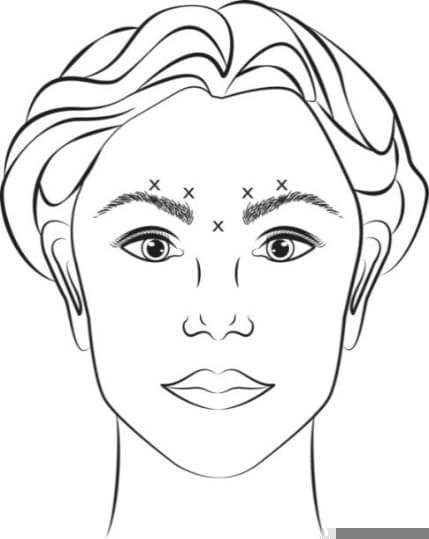
Зморшки у формі « гусячих лапок» при широкій посмішці
|
Рекомендована голка |
Стерильна голка калібру 30/0,30 мм. |
|||
|
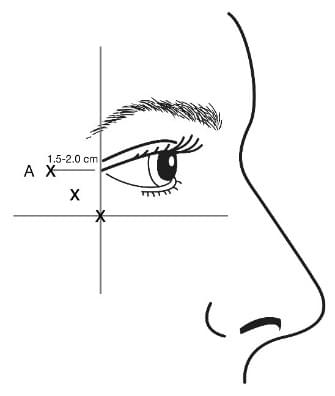
Інструкція і з застосування |
Ін’єкцію необхідно здійснювати, вводячи голку зі скосом направленим уверх і від ока. Першу ін’єкцію (A) потрібно здійснювати приблизно на відстані 1,5-2,0см від зовнішнього кута ока в скронево-орбітальну зону. Якщо зморшки у формі «гусячих лапок» знаходяться вище або нижче зовнішнього кута ока, зробіть ін’єкцію, як вказано на рис. 5. В іншому випадку, якщо зморшки у формі «гусячих лапок» знаходяться переважно нижче зовнішнього кута ока, зробіть ін’єкцію, як вказано на рис. 5а. Для зменшення ризику птозу повіки ін’єкції потрібно здійснювати в скронево-орбітальну зону для забезпечення необхідного віддалення від м’яза, що контролює відкриття повіки.
З обережністю вводити у зону зморщок у формі «гусячих лапок» при широкій посмішці, щоб уникнути попадання у кровоносні судини.
|
|||
|
Рекомендована доза |
0,1мл (4одиниці-Аллерган) у кожну з 3-хділянок кожної сторони м’яза (загалом 6 ділянок для ін’єкцій) вводиться у латеральний круговий м’яз ок; загальна доза становить 24одиниці-Аллерган із загальним об’ємом 0,6мл (12одиниць-Аллерган на кожну сторону). При одночасному лікуванні глабелярних зморщок при максимальному насупленні (доза препарату становить 20одиниць-Аллерган) та зморщок у формі «гусячих лапок» при широкій посмішці (доза препарату становить 24одиниці-Аллерган) загальна доза становить 44 одиниці-Аллерган із загальним об’ємом 1,1 мл (див. інструкцію щодо застосування препарату для лікування глабелярних зморщок та рис. 4). |
|||
|
Максимальна загальна доза |
Для зменшення ризику птозу повіки не слід перевищувати максимальну дозу 4 одиниці-Аллерган на одну ділянку, а також кількість ділянок для ін’єкцій. |
|||
|
Додаткова інформація |
Інтервали між ін’єкціями не повинні становити менше ніж 3 місяці. |
Зморшки на лобі при максимальному підніманні брів
|
Рекомендована голка
|
Стерильна голка калібру 30/0,30 мм. |
|
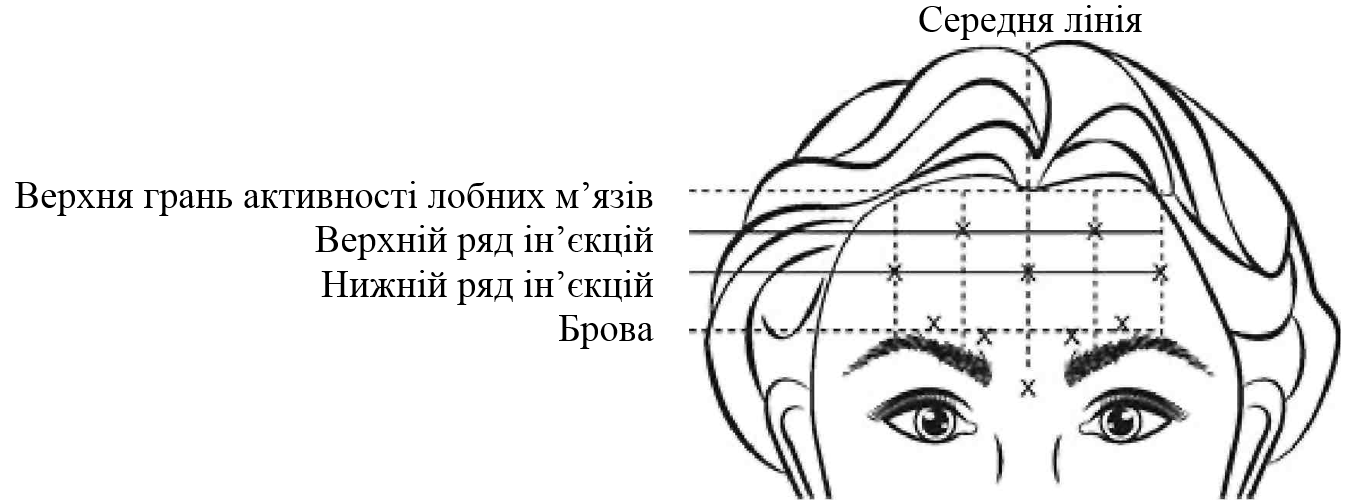
Інструкція із застосування |
Для визначення відповідних місць ін’єкцій в лобні м’язи необхідно оцінити загальне співвідношення між площею лоба пацієнта та поширеністю активності лобних м’язів. Для визначення горизонтальних рядів ін’єкції необхідно виконати легку пальпацію лобних м’язів в стані спокою та при максимальному підніманні брів: • Верхня межа активності лобних м’язів - приблизно 1 см над найвищою складкою на лобі. • Нижній ряд ін’єкцій вводять посередині між верхньою межею активності лобних м’язів та бровою, не менше 2 см над бровою • Верхній ряд ін’єкцій вводять посередині між верхньою межею активності лобних м’язів та нижнім рядом ін’єкцій 5 ін’єкцій повинні бути виконані у точці перетину горизонтальних рядів ін’єкції із вказаними нижче вертикальними орієнтирами: • На нижньому ряду ін’єкції: посередині лба та 0,5-1,5 см медіально до скроневої лінії (до скроневого гребеня), що пальпується, для однієї сторони; повторіть процедуру для іншої сторони. • На верхньому ряду ін’єкції: посередині між латеральною та медіальною зонами на нижньому ряду ін’єкції для однієї сторони; повторіть процедуру для іншої сторони. |
|
|
Рис. 6 З обережністю вводити у зону зморщок на лобі при максимальному підніманні брів, щоб уникнути попадання у кровоносні судини. |
|
Рекомендована доза |
По 0,1мл (4 одиниці-Аллерган) у кожну з п’яти ділянок для ін’єкцій в лобний м’яз, щоб загальна доза становила 20 одиниць-Аллерган із загальним об’ємом 0,5 мл (див. рис. 6). Загальна доза для корекції зморщок на лобі (20 одиниць-Аллерган) одночасно з глабелярними зморшками (20 одиниць-Аллерган) становить 40 одиниць-Аллерган/1,0 мл. При одночасній корекції глабелярних зморщок та зморщок у формі «гусячих лапок» загальна доза препарату становить 64 одиниці-Аллерган, яка включає 20 одиниць-Аллерган для зморщок на лобі, 20 одиниць-Аллерган для глабелярних зморщок (див. інструкції щодо застосування препарату для корекції глабелярних зморщок, та рис. 4) та 24 одиниці-Аллерган для зморщок у формі «гусячих лапок» (див. інструкції щодо застосування препарату для корекції зморщок у формі «гусячих лапок» та рис. 5 та 5а)
|
|
Додаткова інформація |
Інтервали між ін’єкціями не повинні становити менше ніж 3 місяці. Покращення щодо вираженості зморщок на лобі при максимальному підніманні брів спостерігалось впродовж 1 тижня після ін’єкції. Ефект в середньому спостерігався впродовж 4 місяців після ін’єкції. |
Всі показання
Якщо після першого курсу лікування впродовж першого місяця після ін’єкції не з’явилося значного клінічного покращення порівняно з початковим станом, необхідно вжити таких заходів:
- провести клінічне обстеження, що включає електроміографічне обстеження у спеціаліста для виявлення дії токсину на м’яз(-и), в який(-і) здійснювалася ін’єкція;
- провести аналіз причин невдачі, наприклад неправильний вибір м’язів для ін’єкції, недостатня доза, неправильний метод ін’єкції, поява стійкої контрактури, слабкість м’язів-антагоністів, поява антитіл, що нейтралізують токсин;
- провести повторну оцінку доцільності лікування ботулінічним токсином типу А;
- при відсутності будь-яких побічних реакцій після першого курсу лікування провести другий курс лікування таким чином:
1) відрегулювати дозу, взявши до уваги аналіз попередніх неефективних доз;
2) застосувати електроміографію;
3) витримати 3-х місячний інтервал між двома курсами лікування.
У разі неефективного лікування або зменшення ефекту після наступних повторних ін’єкцій необхідно застосовувати інші методи лікування.
Під час лікування дорослих пацієнтів з декількома показаннями, максимальна сумарна доза не повинна перевищувати 400 одиниць-Аллерган. Інтервал між введеннями сумарних доз повинен становити не менше 12 тижнів.
Діти
Безпека та ефективність застосування препарату БОТОКС® для лікування за показаннями, крім описаних в розділі «Показання», не були встановлені. Жодних рекомендацій не надається щодо застосування для лікування за іншими показаннями, крім фокальної спастичності, що пов'язана з дитячим церебральним паралічем. Як зазначено в таблиці 14, на даний час наявні дані щодо застосування, як описано в розділах «Спосіб застосування та дози», «Особливі заходи безпеки», «Побічні реакції» та «Фармакодинаміка».
Таблиця 14
|
Показання |
Вік пацієнта |
|
Фокальна спастичність, пов'язана з дитячим церебральним паралічем |
2 роки (див. розділи «Спосіб застосування та дози», «Особливі заходи безпеки», «Побічні реакції») |
|
Блефароспазм, геміфаціальний спазм та цервікальна дистонія (спастична кривошия) |
12 років (див. розділи «Особливі заходи безпеки», «Побічні реакції») |
|
Первинний гіпергідроз пахвових западин |
12 років (обмежений досвід застосування підліткам 12 - 17 років, див. розділи «Особливі заходи безпеки», «Побічні реакції» та «Фармакодинаміка») |
У постмаркетингових звітах дуже рідко повідомлялось про можливе розповсюдження токсину далеко від місця застосування у дітей, які мали супутні захворювання, переважно у пацієнтів з церебральним паралічем. Загалом в таких випадках застосовувалася доза, що перевищувала рекомендовану.
Були отримані рідкі спонтанні повідомлення про летальні випадки, інколи пов’язані із виникненням аспіраційної пневмонії у дітей з тяжкою формою церебрального паралічу, після застосування ботулінічного токсину, включаючи застосування не за показаннями (наприклад, в ділянку шиї). З особливою обережністю слід застосовувати препарат при лікуванні дітей з тяжкими формами неврологічних порушень, з дисфагією, а також дітей, які нещодавно хворіли на аспіраційну пневмонію або мали захворювання легенів. Лікування ослаблених пацієнтів слід проводити лише тоді, коли доведено, що переваги від лікування перевищують ризики.
Побочные реакции Ботокс пор. д/р-ра д/ин. 200 ЕД-Аллерган фл. №1
Загальні.
У контрольованих клінічних дослідженнях побічні реакції, визначені дослідниками як такі, що відносились до препарату БОТОКС®, спостерігались у 35 % пацієнтів з блефароспазмом, у 28 % з цервікальною дистонією, 17% з дитячим церебральним паралічем, 16 % з фокальною спастичністю верхніх кінцівок та 15% з фокальною спастичністю нижніх кінцівок, пов’язаних з інсультом, 11 % з первинним гіпергідрозом пахвових западин, 23,5 % з вертикальними зморшками між бровами.
У клінічних дослідженнях щодо ідіопатичного сечового міхура частота виникнення побічних реакцій складала 26 % під час першого лікування і зменшилась до 22 % під час другого лікування.
У клінічних дослідженнях щодо нетримання сечі внаслідок нейрогенної гіперактивності детрузора, частота виникнення побічних реакцій складала 32 % під час першого лікування і зменшилась до 18 % під час другого лікування.
У клінічних випробуваннях стосовно хронічної мігрені частота виникнення побічних реакцій складала 26 % під час першого лікування і зменшилась до 11 % під час другого лікування.
У клінічних випробуваннях стосовно зморшок у формі "гусячих лапок" при широкій посмішці, побічні реакції при застосуванні препарату були зареєстровані у 7,6% (24 одиниці-Аллерган тільки для зморшок у формі "гусячих лапок") та 6,2% (44 одиниці-Аллерган: 24 одиниці-Аллерган для зморшок у формі "гусячих лапок" одночасно з введенням 20 одиниць-Аллерган для глабелярних зморшок) пацієнтів порівняно з 4,5% пацієнтів в групі плацебо. Побічні реакції можуть бути пов’язані з лікуванням, процедурою ін’єкції або з обома. Побічні реакції мали помірну та середню тяжкість.
Як правило, побічні реакції виникають упродовж перших кількох днів після ін’єкції і є, зазвичай, тимчасовими та можуть тривати до декількох місяців, у рідких випадках довше.
Локальна слабість м’язу являє собою очікувану фармакологічну дію ботулотоксину у м’язовій тканині.
Як і при будь-яких інших ін’єкціях, з ними може бути пов’язаний локальний біль, запалення, парестезія, гіпоестезія, млявість, набряк, еритема, локалізована інфекція, кровоточивість, та/або синці. Біль чи неприємні відчуття, пов’язані з використанням голки, можуть закінчитись вазовагальними реакціями, включаючи швидкоплинну симптоматичну гіпотензію та непритомність. Повідомлялося також про високу температуру та грипоподібний синдром після ін’єкцій ботулотоксину.
Частота виникнення за показаннями
Нижче для кожного показання наводиться частота виникнення побічних реакцій, задокументована в клінічних дослідженнях. Частота має такі категорії оцінки: дуже часто
(≥ 1/10); часто (≥ 1/100 до ≤ 1/10); нечасто (≥ 1/ 1000 до ≤ 1/100); рідко (≥ 1/10000 до ≤ 1/1000); дуже рідко (≤ 1/ 10000).
Блефароспазм/геміфаціальний спазм
|
Розлади нервової системи: нечасто |
Запаморочення, парез лицьового нерву, ураження лицьового нерву. |
|||||||
|
Розлади органів зору: дуже часто |
Птоз верхньої повіки. |
|||||||
|
часто |
Плямистий кератит, незмикання очної щілини, сухість очей, світлобоязнь, подразнення очей та підвищена сльозоточивість. |
|||||||
|
нечасто |
Кератит, виворіт повіки, диплопія, ентропіон, порушення та розпливчастість зору. |
|||||||
|
рідко |
Набряк повіки. |
|||||||
|
дуже рідко |
Виразковий кератит, дефект епітелію рогівки, перфорація рогівки. |
|||||||
|
Розлади шкіри та підшкірної клітковини: |
||||||||
|
часто нечасто |
Екхімоз. Висипання/дерматит. |
|||||||
|
Загальні розлади та реакції в місці введення: |
||||||||
|
часто |
Подразнення та набряк обличчя. |
|||||||
|
нечасто |
Апатія. |
|||||||
|
Цервікальна дистонія |
||||||||
|
Інфекції та інвазії: |
||||||||
|
часто |
Риніт та інфекція верхніх дихальних шляхів. |
|||||||
|
Розлади нервової системи: |
||||||||
|
часто |
Запаморочення, м’язова гіпертонія, гіпоестезія, сонливість та головний біль. |
|||||||
|
Розлади органів зору: |
||||||||
|
нечасто |
Диплопія та птоз повіки. |
|||||||
|
Респіраторні, грудні та медіастинальні порушення: |
||||||||
|
нечасто |
Диспное та дистонія. |
|||||||
|
Шлунково-кишкові розлади: |
||||||||
|
дуже часто |
Дисфагія (див. розділ Додаткова інформація нижче). |
|||||||
|
часто |
Сухість в ротовій порожнині та нудота. |
|||||||
|
Скелетно-м’язові розлади та розлади сполучної тканини: |
||||||||
|
дуже часто |
М’язова слабкість. |
|||||||
|
часто |
Скелетно-м’язове затвердіння та болісність. |
|||||||
|
Загальні порушення та реакції в місці введення: |
||||||||
|
дуже часто |
Біль. |
|||||||
|
часто |
Астенія, грипоподібне захворювання та нездужання. |
|||||||
|
нечасто |
Підвищення температури тіла. |
|||||||
|
Фокальна спастичність верхніх кінцівок, пов’язана з інсультом |
||||||||
|
Психічні розлади: |
||||||||
|
нечасто |
Депресія та безсоння. |
|||||||
|
Розлади нервової системи: |
||||||||
|
часто |
М’язова гіпертонія. |
|||||||
|
нечасто |
Гіпоестезія, головний біль, парестезія, порушення координації, амнезія. |
|||||||
|
Розлади слуху та внутрішнього вуха: |
||||||||
|
нечасто |
Запаморочення. |
|||||||
|
Судинні розлади: |
||||||||
|
нечасто |
Ортостатична гіпотензія. |
|||||||
|
Шлунково-кишкові розлади: |
||||||||
|
нечасто |
Нудота та оральна парестезія. |
|||||||
|
Розлади шкіри та підшкірної клітковини: |
||||||||
|
часто |
Екхімоз та пурпура. |
|||||||
|
нечасто |
Дерматити, свербіж та висипання. |
|||||||
|
Скелетно-м’язові розлади: |
||||||||
|
часто |
Біль у кінцівках та м’язова слабкість. |
|||||||
|
нечасто |
Артралгія та бурсит. |
|||||||
|
Загальні розлади та реакції в місці введення: |
||||||||
|
часто |
Біль у місці ін’єкції, лихоманка, грипоподібне захворювання, крововилив та подразнення в місці введення. |
|||||||
|
нечасто |
Астенія, біль, гіперчутливість у місці введення, нездужання та периферичний набряк. |
|||||||
|
Деякі з нечастих випадків можуть стосуватися захворювання. Фокальна спастичність нижніх кінцівок, пов’язана з перенесеним інсультом
Розлади шкіри та підшкірної клітковини:
Скелетно-м’язові розлади та розлади сполучної тканини:
Загальні розлади та реакції в місці введення:
В клінічних дослідженнях за участю пацієнтів із спастичністю нижніх кінцівок, частота виникнення раптової слабкості становила 5,9% та 5,3% в групі БОТОКС® та групі плацебо відповідно. Після повторної ін’єкції загальні показники безпеки залишались незмінними. |
||||||||
|
Дитячий церебральний параліч |
||||||||
|
Інфекції та інвазії: |
||||||||
|
дуже часто |
Вірусна інфекція та вушна інфекція. |
|||||||
|
Розлади нервової системи: |
||||||||
|
часто |
Сонливість, порушення ходи та парестезія. |
|||||||
|
Розлади шкіри та підшкірної клітковини: |
||||||||
|
часто |
Висипи. |
|||||||
|
Скелетно-м’язові розлади та розлади сполучної тканини: |
||||||||
|
часто |
Міалгія, м’язова слабкість та біль у кінцівках. |
|||||||
|
Ниркові розлади та розлади сечовивідної системи: |
||||||||
|
часто |
Нетримання сечі. |
|||||||
|
Травми, отруєння та процедурні ускладнення: часто Загальні розлади реакції в місці введення: |
Слабкість. |
|||||||
|
Часто |
Нездужання, біль у місці ін’єкції та астенія. |
|||||||
|
Ідіопатичний гіперактивний сечовий міхур |
||||||||
|
Інфекції та інвазії: дуже часто часто Ниркові розлади та розлади сечовивідної системи: дуже часто часто |
Інфекція сечовивідних шляхів. Бактеріурія. Дизурія. Затримка сечовиділення, неповне звільнення сечового міхура*, полакіурія, лейкоцитурія. |
|||||||
*об’єм сечі при неповному звільненні сечового міхура, що не потребує катетеризації.
Побічними реакціями, пов’язаними з процедурою, з частотою виникнення «часто» були дизурія та гематурія.
У 6,5 % пацієнтів було ініційовано застосування стерильної переміжної катетеризації після лікування препаратом БОТОКС® 100 одиниць - Аллерган у порівнянні 0,4 % пацієнтів у групі плацебо.
З 1242 пацієнтів, що брали участь у плацебо-контрольованих клінічних дослідженнях, 41,4 % пацієнтів (кількість – 514) були віком ≥ 65 років та 14,7 % (кількість – 182) – віком ≥ 75 років. В цих дослідженнях не було виявлено суттєвої різниці у профілі безпеки після лікування препаратом БОТОКС® між пацієнтами ≥ 65 років та пацієнтами < 65 років, за виключенням інфекцій сечовивідних шляхів, які частіше зустрічалися у пацієнтів похилого віку в обох групах: БОТОКС® та плацебо, у порівнянні із молодшими учасниками дослідження.
При повторному застосуванні препарату не спостерігалось змін у загальному профілі безпеки.
Нетримання сечі в результаті нейрогенної гіперактивності детрузора
|
Інфекції та інвазії: дуже часто |
Інфекція сечовивідних шляхів. |
|
Психічні розлади: часто |
Безсоння. |
|
Шлунково-кишкові розлади: часто |
Закреп. |
|
Скелетно-м’язові розлади та розлади сполучної тканини: часто |
М’язова слабкість, м’язовий спазм. |
|
Ниркові розлади та розлади сечовивідної системи: дуже часто часто |
Затримка сечовиділення. Гематурія*, дизурія, дивертикул сечового міхура. |
|
Загальні розлади та реакції в місці введення: часто |
Втома, порушення ходи. |
|
Травми, отруєння та процедурні ускладнення: часто |
Автономна дизрефлексія*, слабкість. |
* побічні реакції, пов’язані з процедурою
У клінічних дослідженнях інфекція сечовивідних шляхів спостерігалась у 49,2 % пацієнтів, які проходили лікування препаратом БОТОКС®, 200 одиниць - Аллерган та у 35,7 % пацієнтів групи плацебо (53,0 % пацієнтів з розсіяним склерозом, які проходили лікування препаратом БОТОКС®, 200 одиниць - Аллерган та 29,3 % групи плацебо; 45,4 % пацієнтів із пошкодженням спинного мозку, які проходили лікування препаратом БОТОКС®, 200 одиниць - Аллерган та 41,7 % групи плацебо). Затримка сечовиділення спостерігалася у 17,2 % пацієнтів, які проходили лікування препаратом БОТОКС®, 200 одиниць - Аллерган та у 2,9 % пацієнтів групи плацебо (28,8 % пацієнтів з розсіяним склерозом, які проходили лікування препаратом БОТОКС®, 200 одиниць - Аллерган та 4,5 % групи плацебо; 5,4 % пацієнтів із пошкодженням спинного мозку, які проходили лікування препаратом БОТОКС®, 200 одиниць - Аллерган та 1,4 % групи плацебо).
Змін у типі побічних реакцій при повторному застосуванні не спостерігалось.
У пацієнтів із розсіяним склерозом, залучених до пілотних досліджень, не спостерігалось значних відмінностей у частоті випадків загострення захворювання розсіяного склерозу, розрахованого за рік (тобто, кількість випадків загострення розсіяного склерозу на пацієнта за рік): БОТОКС® - 0,23, плацебо - 0,20).
Серед пацієнтів, які не застосовували катетеризацію, як основу до початку лікування, було ініційовано катетеризацію у 38,9 % пацієнтів після лікування препаратом БОТОКС®, 200 одиниць - Аллерган та 17,3 % плацебо.
Хронічна мігрень
|
Розлади нервової системи: часто |
Головний біль, мігрень, парез обличчя. |
|
Розлади органів зору: часто |
Птоз повіки. |
|
Розлади шкіри та підшкірної клітковини: часто нечасто |
Свербіж, висипи. Біль шкіри. |
|
Скелетно-м’язові розлади та розлади сполучної тканини: часто
нечасто: |
Біль у шиї, міалгія, скелетно-м’язовий біль та ригідність, м’язові спазми, м’язове напруження, м’язова слабкість. Біль у щелепі. |
|
Загальні розлади та реакції в місці введення: часто |
Біль у місці введення. |
|
Шлунково-кишкові розлади: нечасто |
Дисфагія. |
Відсоток пацієнтів, які припинили лікування через виникнення побічних реакцій, у випробуваннях складав 3,8 % для препарату БОТОКС® та 1,2 % для плацебо.
|
Первинний гіпергідроз пахвових западин |
|
|
Розлади нервової системи: |
|
|
часто |
Головний біль та парестезії. |
|
Судинні розлади: |
|
|
часто |
Припливи. |
|
Шлунково-кишкові розлади: |
|
|
нечасто |
Нудота. |
|
Розлади шкіри та підшкірної клітковини: |
|
|
часто |
Гіпергідроз (непахвове потіння) незвичайний запах шкіри, свербіж, підшкірні вузлики та облисіння. |
|
Скелетно-м’язові розлади та розлади сполучної тканини: |
|
|
часто нечасто |
Біль у кінцівках. М’язова слабкість, міалгія, артропатія. |
|
Загальні розлади та реакції в місці введення: дуже часто |
Біль у місці ін’єкції. |
|
часто |
Біль, набряк в місці ін’єкції, крововиливи в місці ін’єкції, гіперчутливість у місці ін’єкції, подразнення в місці ін’єкції, астенія та реакції в місці ін’єкції. |
У клінічних дослідженннях при лікуванні первинного пахвового гіпергідрозу збільшення непахвового потіння спостерігалося упродовж 1 місяця після ін’єкції, локалізація у конкретних анатомічних ділянках не проявлялася. Це явище припинилося протягом 4 місяців.
Про слабість рук повідомлялося рідко (0,7 %), вона була помірною, тимчасовою, не потребувала лікування та минала без наслідків. Цей негативний ефект можна віднести до лікувальних процедур та/або техніки виконання ін’єкцій. У поодиноких випадках м’язової слабкості можна провести неврологічне обстеження. Крім того, перед подальшими ін’єкціями можна порадити переглянути техніку їх виконання, щоб гарантувати їх підшкірну локалізацію.
В неконтрольованому випробуванні з безпеки препарату БОТОКС® (50 одиниць - Аллерган у кожну пахвову западину) у пацієнтів-підлітків віком від 12 до 17 років (кількість – 144), до побічних реакцій, що виникали більше одного разу (у двох пацієнтів кожна) відносяться біль у місці ін’єкції та гіпергідроз (непахвове потіння).
|
Вертикальні зморшки між бровами (глабелярні зморшки) |
|
|
Інфекції та інвазії: |
|
|
нечасто |
Інфекція. |
|
Психічні розлади: |
|
|
нечасто |
Відчуття тривоги. |
|
Розлади нервової системи: |
|
|
часто |
Головний біль, парестезія. |
|
нечасто |
Запаморочення. |
|
Розлади органів зору: |
|
|
часто |
Птоз повіки. |
|
нечасто |
Блефарит, біль в очах, порушення зору (включаючи розпливчатий зір). |
|
Шлунково-кишкові розлади: |
|
|
часто |
Нудота. |
|
нечасто |
Сухість ротової порожнини. |
|
Розлади шкіри та підшкірної клітковини: |
|
|
часто |
Еритема, напруженість шкіри. |
|
нечасто |
Набряк (обличчя, повік, периорбітальної зони), фотосенсибілізація, свербіж, сухість шкіри. |
|
Скелетно-м’язові розлади: |
|
|
часто |
Локалізована м’язова слабкість. |
|
нечасто |
Посмикування м’язів. |
|
Загальні розлади та реакції в місці введення: |
|
|
часто |
Біль у ділянці обличчя, набряк у місці ін’єкції, екхімоз, біль у місці ін’єкції, подразнення у місці ін’єкції. |
|
нечасто |
Грипоподібний синдром, астенія, лихоманка. |
З моменту надходження препарату на ринок для лікування глабелярних зморшок повідомлялось про такі побічні дії або суттєві з медичної точки зору випадки: висипання, кропив’янка, денервація/ м’язова атрофія, дизартрія, страбізм, периферична невропатія, біль у животі, діарея, блювання, анорексія, гіпоакузія, шум у вухах, запаморочення, лицьовий параліч, парез лицьового нерва, плексопатія плечового сплетіння, радикулопатія, непритомність, гіпоестезія, нездуження, міальгія, міастенія гравіс, парестезія, мультиформна еритема, свербіж, псоріазоподібний дерматит, гіпергідроз, анафілактична реакція (ангіоневротичний (аллергічний) набряк, бронхоспазм), алопеція та мадароз.
Зморшки у формі "гусячих лапок"
Нижчезазначені побічні реакції були зареєстровані при проведенні плацебоконтрольованих подвійних сліпих клінічних досліджень після ін’єкції 24 одиниць препарату виключно для лікування зморшок у формі "гусячих лапок":
Розлади органів зору:
|
часто |
Набряк повіки |
Загальні розлади та реакції в місці введення:
|
часто |
Крововиливи у місці ін’єкції *, гематома у місці ін’єкції * |
|
нечасто |
Біль у місці ін’єкції *, парестезія у місці ін’єкції |
*побічні реакції, пов’язані з процедурою
Зморшки у формі "гусячих лапок" та глабелярні зморшки
Нижчезазначені побічні реакції були зареєстровані при проведенні плацебоконтрольованих подвійних сліпих клінічних досліджень після ін’єкції 44 одиниць-Аллерган препарату (одночасне лікування зморшок у формі "гусячих лапок" та глабелярних зморшок):
Загальні розлади та реакції в місці введення:
|
часто |
Гематома у місці ін’єкції* |
|
нечасто |
Крововиливи у місці ін’єкції *, біль у місці ін’єкції* |
*побічні реакції, пов’язані з процедурою
Після повторної ін’єкції загальні показники безпеки залишались незмінними.
Додаткова інформація
Також повідомлялось по побічні реакції наведені нижче після надходження препарату на ринок:
|
Серцеві розлади: |
Аритмія, інфаркт міокарда. |
|
Розлади слуху та внутрішнього вуха: |
Гіпоакузія, вушний шум та запаморочення. |
|
Розлади органів зору: |
Закритокутова глаукома (при лікуванні блефароспазму), страбізм, розпливчатий зір, порушення зору. |
|
Шлунково-кишкові розлади: |
Біль у животі, пронос, закреп, сухість в ротовій порожнині, дисфагія, нудота та блювота. |
|
Загальні розлади та реакції в місці введення: |
Денервація, нездужання та лихоманка. |
|
Розлади іммуної системи: |
Анафілаксія, ангіоневротичний набряк, сивороткова хвороба, крапив’янка. |
|
Метаболізм та шлунково-кишкові розлади: |
Анорексія. |
|
Скелетно-м’язові розлади: |
М’язова атрофія та міальгія. |
|
Розлади нервової системи: |
Бронхіальна плексопатія, дистонія, дизартрія, парез лицьового нерва, гіпоестезія, м’язова атрофія, міастенія гравіс, периферична нейропатія, парестезія, радикулопатія, пароксизм, непритомність, лицьовий параліч. |
|
Респіраторні, грудні та медіастинальні порушення: |
Аспіраційна пневмонія (зі смертельним наслідком у кількох випадках), диспное, дихальна недостатність та припинення дихання, |
|
Розлади шкіри та підшкірної клітковини: |
Алопеція, псоріазоподібний дерматит, мультиформна еритема, гіпергідроз, мадароз, свербіж та висипи. |
(див. розділ «Особливості застосування»).
Передозировка Ботокс пор. д/р-ра д/ин. 200 ЕД-Аллерган фл. №1
Передозування препаратом БОТОКС® є відносним поняттям та залежить від дози, зони ін’єкції та основних властивостей тканин. Жодних повідомлень про випадки системної токсичності внаслідок випадкової ін’єкції препарату БОТОКС® не було. Перевищення дози може стати причиною локалізованого або поширеного, та часткового або повного нервово-м’язового паралічу.
Випадки ковтання препарату БОТОКС® невідомі.
Ознаки та симптоми передозування не з’являються одразу ж після ін’єкції. В разі випадкової ін’єкції, ковтання або виникнення підозри щодо передозування, пацієнт повинен перебувати під медичним наглядом кілька тижнів, щоб виявити прогресуючі ознаки та симптоми м’язової слабкості, що може виникнути у місці ін’єкції або у віддаленому від ін’єкції місці, включаючи птоз, диплопію, дисфагію, дизартрію, загальну слабкість або респіраторні розлади. Ці пацієнти повинні пройти подальше медичне обстеження та негайно отримати необхідну медичну допомогу, яка може включати госпіталізацію.
При ураженні мускулатури ротової частини глотки та стравоходу може розвинутися аспіраційна пневмонія. Якщо розвинулася надмірна м’язова слабкість або параліч дихальних м’язів, необхідно провести інтубацію трахеї та штучну вентиляцію легенів до відновлення нормальної функції дихання. Додатково до заходів загальної підтримуючої терапії можуть бути необхідними застосування трахеостомії та тривалої штучної вентиляції легень.
Применение в период беременности или кормления грудью Ботокс пор. д/р-ра д/ин. 200 ЕД-Аллерган фл. №1
Препарат БОТОКС® не застосовують під час вагітності та у жінок, що планують вагітність та не вживають контрацептиви, за вийнятком випадків особливої необхідності. Немає достатніх даних щодо використання ботулінічного токсину типу А у вагітних жінок. Немає інформації щодо потрапляння препарату БОТОКС® у грудне молоко. Не рекомендується застосовувати жінкам у період годування груддю. Якщо під час лікування препаратом БОТОКС® у пацієнтки діагностовано вагітність, слід негайно припинити лікування. Немає достатніх даних щодо впливу ботуліничного токсину типу А на фертильність жінок, що можуть народжувати дітей.
Дослідження на тваринах показали репродуктивну токсичність (доза вища 4 одиниць - Аллерган/кг у тварин чоловічої статі та доза вища 8 одиниць - Аллерган/кг у тварин жіночої статі). Спостерігались випадки затримки фертильності пропорційно збільшенню доз. Хоча траплялись випадки ненастання запліднення, жодного негативного впливу на кількість або живучість ембріонів не виявлено. Додаткові доклінічні дослідження не виявили значної загрози для людини при застосуванні у відповідних клінічних дозах. Потенційний ризик для людини невідомий.
Условия хранения Ботокс пор. д/р-ра д/ин. 200 ЕД-Аллерган фл. №1
Термін придатності
3 роки.
Стабільність зберігається протягом 24 годин при температурі від 2 до 8 °С після відновлення флакону.
Після приготування у шприці розчин слід використати негайно!
Препарат не можна застосовувати після закінчення терміну придатності, вказаного на упаковці.
Умови зберігання
Зберігати у холодильнику (при температурі від 2 до 8 °С) або у морозильній камері (при температурі мінус 5 °С та нижче).
Зберігати у недоступному для дітей місці.
Приготовлений розчин у флаконі можна зберігати до 24 годин у холодильнику при температурі від 2 до 8 °С.
Упаковка
Порошок для розчину для ін’єкцій по 100 або 200 одиниць - Аллерган у флаконі. По 1 флакону разом з інструкцією про застосування вкладено у картонну коробку.
Категорія відпуску
За рецептом.
Регистрационные данные Ботокс пор. д/р-ра д/ин. 200 ЕД-Аллерган фл. №1
Производитель: Аллерган Фармасьютікалз, Ірландія
Фарм. группа: Миорелаксанты с периферическим механизмом действия. Ботулинический токсин.
Регистрация: 805/10-300200000
Код АТХ:
(M) Лекарственные средства для лечения заболеваний костно-мышечной системы
(M03) Миорелаксанты
(M03A) Миорелаксанты периферического действия
(M03AX) Прочие миорелаксанты периферического действия
(M03AX01) Ботулинический нейротоксин типа A-гемагглютинин комплекс
Дата обновления информации: 23.11.2021 г.
© likiteka 2024
- Диспорт пор. д/п ин. р-ра 500 ЕД фл. №1, Іпсен Біофарм Лтд., Великобританія
- Диспорт пор. д/р-ра д/ин. 300 ЕД фл. №1, Іпсен Біофарм Лтд., Великобританія
- Нейронокс пор. лиофил. д/п р-ра д/ин. 100 ЕД фл. №1, Медітокс Інк., Республіка Корея
- Ботулакс Ботулинический Токсин Типа А лиофил. д/р-ра д/ин. 50 ЕД фл. №1, Хугель, lнк., Корея
- Ботулакс Ботулинический Токсин Типа А лиофил. д/р-ра д/ин. 100 ЕД фл. №1, Хугель, lнк., Корея