Фейба лиофил. пор. 500 ЕД фл., Раств. и набор д/раст. и введ.
Бакстер АГ, АвстріяСостав
діюча речовина: Factor VIII Inhibitor Bypassing Activity;
1 флакон з порошком містить:
| Діюча речовина |
Вміст речовини на флакон |
|
|
500 Од.* |
1000 Од.* |
|
|
білок плазми людини з активністю, шунтуючою інгібітори до фактора коагуляції крові людини VIII |
200-600 мг
|
400-1200 мг |
|
500 Од. |
1000 Од. |
|
* Розчин, що містить 1 одиницю препарату ФЕЙБА, скорочує активований частковий тромбопластиновий час (АЧТЧ) плазми з інгібітором до фактора VIII до 50 % порівняно з розчином буфера (холостий дослід).
Препарат ФЕЙБА містить також фактори II, IX і X, переважно в неактивованій формі, а також активований фактор VII; коагулянтний антиген фактора VIII (F VIII C:Ag) присутній у концентрації до 0,1 Од. на 1 одиницю препарату ФЕЙБА. Препарат може містити слідові кількості факторів калікреїн-кінінової системи.
допоміжні речовини: натрію хлорид, натрію цитрат, дигідрат;
флакон з розчинником містить воду для ін’єкцій.
Лікарська форма
Порошок для розчину для інфузій/ін’єкцій.
Основні фізико-хімічні властивості: порошок або крихка речовина від білого до майже білого або блідо-зеленого кольору.
Фармакотерапевтична група. Фактори згортання крові. Білки з активністю, шунтуючою інгібітори до фактора VIII. Код АТХ В02В D03.
Імунологічні і біологічні властивості
Препарат ФЕЙБА був розроблений на початку сімдесятих, його активність шунтування інгібіторів фактора VIII була підтверджена як in vitro, так і in vivo, механізм його дії досі залишається предметом наукового обговорення. Препарат ФЕЙБА, як було з’ясовано у ході вивчення активності препарату, створений на основі протромбінового комплексу, зимогенів, які представлені прокоагулянтами (протромбін, фактор VII, фактор IX, фактор X) та антикоагулянтом (білок C) у відносно рівних кількостях для досягнення умовної одиниці активності препарату ФЕЙБА, але вміст його прокоагулянтних ферментів є відносно низьким. ФЕЙБА, таким чином, містить проферменти факторів протромбінового комплексу, але тільки в дуже невеликих кількостях їх активованих продуктів, серед яких вміст фактора VIIa є найвищим.
Поточні наукові роботи відзначають роль специфічних компонентів активованого протромбінового комплексу – протромбіну (фактора II) і активованого фактора X (фактора Xa) у механізмі дії препарату ФЕЙБА.
ФЕЙБА контролює кровотечу шляхом індукції та сприяння утворенню тромбіну, процесу, для якого формування протромбінового комплексу має вирішальне значення. Ряд біохімічних in vitro та in vivoдосліджень показали, що фактор Xa і протромбін відіграють основну роль в активності препарату ФЕЙБА. Протромбіновий комплекс, як було встановлено, є основною мішенню для препарату ФЕЙБА. Крім протромбіну і фактора Xa препарат ФЕЙБА містить інші білки протромбінового комплексу, що також можуть сприяти підтриманню гемостазу у пацієнтів з гемофілією з наявністю інгібіторів.
Досвід застосування пацієнтам, хворим на гемофілію В, з інгібіторами до фактора IX обмежений через рідкість захворювання. П’ять пацієнтів з гемофілією B з наявністю інгібіторів отримали лікування препаратом ФЕЙБА у ході проведення клінічних досліджень у разі необхідності, з метою профілактики або у разі хірургічних втручань.
У проспективному відкритому рандомізованому клінічному дослідженні з паралельними групами за участю пацієнтів з гемофілією А або B зі стійким високим титром інгібіторів (090701, PROOF) 36 пацієнтів були рандомізовані або у групи профілактичного застосування препарату впродовж 12 місяців ± 14 днів, або у групи застосування препарату у разі необхідності. 17 пацієнтів з групи профілактичного застосування отримували препарат ФЕЙБА у дозі 85 ± 15 Од./кг, що вводилася через день, а 19 пацієнтів з групи застосування препарату у разі необхідності отримували лікування препаратом на індивідуальній основі, за рішенням лікаря. Два пацієнти з гемофілією B з наявністю інгібіторів отримували лікування препаратом у групі застосування препарату у разі необхідності і один пацієнт з гемофілією B отримував лікування у групі профілактичного застосування препарату.
Медіана ABR (річна частота випадків кровотеч) для всіх типів епізодів кровотеч у пацієнтів з групи профілактичного застосування препарату (медіана ABR = 7,9) була меншою, ніж у пацієнтів з групи застосування препарату у разі необхідності (медіана ABR = 28,7), що становить до 72,5 % зниження в медіані ABR між групами лікування.
В іншому завершеному проспективному неінтервенційному спостережувальному дослідженні періопераційного застосування препарату ФЕЙБА (PASS-INT-003, SURF) в цілому 34 хірургічні процедури були проведені у 23 пацієнтів. Більшість пацієнтів (18) були пацієнтами з вродженою гемофілією А з наявністю інгібіторів, двоє пацієнтів – пацієнтами з гемофілією B з наявністю інгібіторів, і троє пацієнтів – пацієнтами з набутою гемофілією А з наявністю інгібіторів. Тривалість застосування препарату ФЕЙБА знаходилася в діапазоні від 1 до 28 днів, у середньому 9 днів, і з медіаною 8 днів. Середня кумулятивна доза становила 88347 Од., а медіана дози становила 59000 Од. Для пацієнтів з гемофілією B з наявністю інгібіторів найдовша експозиція до препарату ФЕЙБА становила 21 день, а максимальна доза – 7324 Од.
Крім того, відзначено 36 клінічних випадків, коли препарат ФЕЙБА застосовували для лікування і попередження епізодів кровотеч у пацієнтів з гемофілією B з наявністю інгібітору до фактора IX (24 пацієнти з гемофілією B з наявністю інгібіторів отримували лікування препаратом у разі необхідності, чотири пацієнти з гемофілією B з наявністю інгібіторів отримували препарат профілактично і вісім пацієнтів з гемофілією B з наявністю інгібіторів отримували препарат у разі проведення хірургічних процедур).
Існують також ізольовані повідомлення про застосування препарату ФЕЙБА для лікування пацієнтів з набутими інгібіторами до факторів X, XI і XIII.
Оскільки механізм дії препарату досі обговорюється, неможливо зробити остаточного висновку про його фармакокінетичні властивості.
Показания Фейба лиофил. пор. 500 ЕД фл., Раств. и набор д/раст. и введ.
- Лікування кровотеч у пацієнтів з гемофілією А та інгібіторами до фактора VIII;
- лікування кровотеч у пацієнтів з гемофілією В та інгібіторами до фактора VIII за відсутності іншого специфічного лікування;
- лікування кровотеч у пацієнтів, не хворих на гемофілію з набутими інгібіторами до фактора VIII;
- профілактика кровотеч у пацієнтів з інгібіторною формою гемофілії А, які пережили значну кровотечу або мають високий ризик значної кровотечі.
Противопоказания Фейба лиофил. пор. 500 ЕД фл., Раств. и набор д/раст. и введ.
Препарат ФЕЙБА не можна використовувати у таких ситуаціях, якщо існують терапевтичні альтернативи:
- підвищена чутливість до препарату або будь-яких його компонентів;
- синдром дисемінованого внутрішньосудинного згортання (ДВЗ-синдром);
- гострий тромбоз або емболія (включаючи інфаркт міокарда), див. розділ «Особливості застосування».
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Адекватні та добре контрольовані дослідження комбінованого або послідовного застосування препарату ФЕЙБА і рекомбінантного фактора VIІа або антифібринолітиків не проводилися. Слід враховувати можливість розвитку тромботичних ускладнень у разі застосування системних антифібринолітиків, таких як транексамінова кислота і амінокапронова кислота, під час лікування препаратом ФЕЙБА. Тому антифібринолітики не слід застосовувати протягом приблизно 6-12 годин після застосування препарату ФЕЙБА. У разі супутнього застосування препарату з рекомбінантним фактором VIІа (rFVIIa) потенційну лікарську взаємодію виключити не можна з огляду на наявні in vitro дані та дані клінічних спостережень.
Особливості застосування
Ризик розвитку тромботичних і тромбоемболічних явищ
В ході лікування препаратом ФЕЙБА спостерігалися тромботичні і тромбоемболічні явища, у тому числі дисеміноване внутрішньосудинне згортання, венозний тромбоз, легенева емболія, інфаркт міокарда та інсульт.
Ризик тромботичних і тромбоемболічних явищ може підвищуватися при високих дозах препарату ФЕЙБА. Декілька з цих явищ виникали при введенні доз понад 200 Од./кг/добу або у разі наявності інших факторів ризику тромбоемболічних явищ. Потрібно завжди враховувати можливу наявність таких факторів ризику у пацієнтів з вродженою або набутою гемофілією.
Не слід перевищувати одноразову дозу 100 Од./кг маси тіла і добову дозу 200 Од./кг маси тіла, окрім випадків, коли тяжкість кровотечі виправдовує застосування більш високих доз препарату. Стан пацієнтів, які отримують препарат в дозі більше 100 Од./кг маси тіла, необхідно контролювати щодо розвитку ДВЗ-синдрому та/або гострої коронарної ішемії. У разі призначення препарату з метою зупинки кровотечі застосовування повинно тривати лише впродовж часу, необхідного для досягнення терапевтичного ефекту.
Пацієнти з синдромом дисемінованого внутрішньосудинного згортання (ДВЗ-синдромом), прогресуючим атеросклеротичним захворюванням, травмами з роздавлюванням тканин, септицемією або супутнім лікуванням рекомбінантним фактором VIIa можуть мати підвищений ризик тромботичних явищ.
Препарат ФЕЙБА потрібно застосовувати з особливою обережністю і лише тоді, коли для лікування пацієнтів з підвищеним ризиком тромбоемболічних ускладнень відсутні альтернативні лікарські засоби. Ця група пацієнтів включає, але не обмежується пацієнтами з ішемічною хворобою серця в анамнезі, захворюваннями печінки, ДВЗ-синдромом, артеріальним або венозним тромбозом, післяопераційною іммобілізацією, пацієнтами літнього віку та новонародженими.
Якщо спостерігаються ознаки чи симптоми тромботичних і тромбоемболічних явищ, слід негайно припинити інфузію і розпочати відповідні діагностичні і терапевтичні заходи.
У ситуаціях, які зазначені нижче, препарат ФЕЙБА слід застосовувати, лише якщо не очікується жодних реакцій на лікування відповідним фактором коагуляції крові, зокрема, у разі високого титру інгібіторів, загрозливої для життя кровотечі або ризику кровотечі (наприклад, після травми чи операції):
- синдром дисемінованого внутрішньосудинного згортання (за результатами лабораторних аналізів та/або клінічними симптомами);
- ураження печінки, оскільки через сповільнений кліренс активованих факторів коагуляції у пацієнтів з порушеною функцією печінки спостерігається підвищений ризик розвитку ДВЗ-синдрому;
- ішемічна хвороба серця, гострий тромбоз та/або емболія.
Пацієнти, які отримують лікування препаратом ФЕЙБА, повинні знаходитися під контролем щодо розвитку ДВЗ-синдрому, гострої коронарної ішемії та симптомів інших тромботичних або тромбоемболічних явищ. У разі появи перших ознак тромботичних і тромбоемболічних явищ введення препарату слід негайно припинити та вжити відповідних діагностичних і терапевтичних заходів.
Реакції підвищеної чутливості алергічного типу
Препарат ФЕЙБА може спричинити появу реакцій підвищеної чутливості алергічного типу, які включають кропив’янку, ангіоневротичний набряк, шлунково-кишкові розлади, бронхоспазм і артеріальну гіпотензію; ці реакції можуть бути тяжкими і системними (наприклад, анафілаксія з кропив’янкою і ангіоневротичним набряком, бронхоспазм і циркуляторний шок). Повідомлялося також про інші інфузійні реакції, такі як озноб, лихоманка і артеріальна гіпертензія.
Пацієнтів потрібно повідомити про ранні ознаки підвищеної чутливості, у тому числі еритему, шкірний висип, загальну кропив’янку, свербіж, ускладнене дихання/задишку, стиснення в грудях, загальне нездужання, запаморочення, падіння артеріального тиску і навіть алергічний шок. У разі появи цих ознак або симптомів інфузійної реакції/реакції підвищеної чутливості слід припинити застосування препарату і надати відповідну медичну допомогу.
При розгляді повторного призначення препарату ФЕЙБА пацієнтам з відомою підвищеною чутливістю або підозрою на підвищену чутливість до препарату або будь-яких його компонентів потрібно ретельно зважити очікувані переваги і ризики повторного впливу, враховуючи відомий або підозрюваний тип підвищеної чутливості пацієнта (алергічний або неалергічний), з урахуванням потенційної лікувальної та/або профілактичної терапії або призначення альтернативних лікарських засобів.
Контроль лікування
Не слід перевищувати разові дози 100 Од./кг маси тіла і добові 200 Од./кг маси тіла. За пацієнтами, які отримують разові дози 100 Од./кг маси тіла, слід проводити ретельне спостереження, зокрема, щодо можливого розвитку ДВЗ-синдрому або симптомів гострої коронарної ішемії. Високі дози препарату ФЕЙБА слід призначати тільки на час, необхідний для зупинки кровотечі.
У разі появи клінічно виражених порушень артеріального тиску і частоти пульсу, утруднення дихання, болю в грудній клітці і кашлю введення препарату необхідно негайно припинити і розпочати відповідні діагностичні і лікувальні заходи. Суттєвими лабораторними ознаками ДВЗ-синдрому є зниження фібриногену, зменшення кількості тромбоцитів та/або присутність продуктів деградації фібрину/фібриногену (ПДФ). Іншими ознаками є значне подовження тромбінового часу, протромбінового часу або активованого часткового тромбопластинового часу (АЧТЧ). У хворих на інгібіторну гемофілію або з набутими інгібіторами до факторів VIII, IX та/або XI АЧТЧ подовжений під дією основної хвороби.
Пацієнти з інгібіторною гемофілією або з набутими інгібіторами до факторів коагуляції, які проводять лікування препаратом ФЕЙБА, можуть одночасно мати підвищену схильність до кровотеч і підвищений ризик тромбозів.
Лабораторні аналізи та клінічна ефективність
Аналізи in vitro, такі як АЧТЧ, час згортання цільної крові і тромбоеластограма, як показники ефективності не обов’язково повинні корелювати з клінічною картиною. Тому спроби досягти нормалізації цих показників шляхом збільшення доз препарату ФЕЙБА не можуть бути ефективними, до того ж від них слід категорично відмовитися через підвищений ризик розвитку ДВЗ-синдрому в результаті передозування.
Значення контролю кількості тромбоцитів
Оскільки для досягнення ефективності дії препарату ФЕЙБА потрібна наявність великої кількості функціонально повноцінних тромбоцитів, в разі неадекватної відповіді на лікування препаратом рекомендується контроль кількості тромбоцитів.
Застереження
Заходи щодо запобігання передачі інфекції
При використанні лікарських препаратів з крові або плазми крові людини вживають стандартних заходів, спрямованих на запобігання передачі пацієнтам збудників інфекції. До них належать ретельний відбір донорів, перевірка окремих порцій і пулів плазми за маркерами вірусів та інфекцій, вжиття ефективних виробничих заходів для інактивації/знищення вірусів. Незважаючи на це, при введенні лікарських препаратів, виготовлених з крові або плазми людини, не можна цілком виключити можливість передачі збудників інфекції, у тому числі невідомих або нових на сьогодні вірусів та інших патогенів.
Заходи, що вживаються, вважаються ефективними для оболонкових вірусів, таких як вірус імунодефіциту людини (ВІЛ), вірус гепатиту В і вірус гепатиту С, а також для необолонкових вірусів, таких як вірус гепатиту А. Заходи, що вживаються, можуть мати обмежену ефективність щодо необолонкових вірусів, таких як парвовірус В19. Інфікування парвовірусом В19 може бути серйозним для вагітних (інфікування плода) і пацієнтів з імунодефіцитом або підвищеним еритропоезом (наприклад з гемолітичною анемією).
Потрібно розглянути питання проведення вакцинації (від гепатиту A і B) пацієнтам, яким регулярно/повторно застосовують препарати отримуваного з плазми крові людини фактора VIII.
Настійно рекомендується записувати назву і номер серії препарату щоразу при введенні пацієнту препарату ФЕЙБА з метою встановлення зв’язку між пацієнтом і серією препарату.
Неоднозначність відповіді на застосування лікарських засобів з шунтуючою активністю
Через фактори, які пов’язані з конкретним пацієнтом, реакція на препарат може відрізнятися, і у конкретній ситуації кровотечі пацієнти, у яких спостерігається недостатня реакція на один препарат, можуть реагувати на інший препарат. У разі недостатньої реакції на один препарат слід розглянути можливість використання іншого препарату.
Анамнестичні реакції
Введення препарату ФЕЙБА пацієнтам з інгібіторами може призвести до початкового анамнестичного підвищення рівнів інгібіторів. При неперервному введенні препарату ФЕЙБА рівень інгібіторів з часом може зменшитися. Як показують опубліковані дані, ефективність препарату ФЕЙБА не знижується.
Антитіла до поверхневого антигену гепатиту В та інтерпретація результатів аналізу
Після введення високих доз препарату ФЕЙБА транзиторне підвищення рівнів пасивно переданих антитіл до поверхневого антигену гепатиту В може призвести до помилкової інтерпретації позитивних результатів серологічних тестів.
Педіатрична популяція
Повідомлення та обмежені дані, отримані у ході клінічних досліджень, показують, що препарат ФЕЙБА можна застосовувати дітям віком до 6 років. Так само, як і у дорослих, режим дозування повинен бути адаптований до клінічного стану дитини.
Профілактичне застосування препарату пацієнтам з гемофілією В з наявністю інгібіторів
Через рідкість захворювання існують лише обмежені клінічні дані щодо застосування препарату ФЕЙБА для профілактики кровотечі у пацієнтів, хворих на гемофілію (клінічні випадки, описані в літературі (n = 4), і клінічні дані, отримані у ході досліджень 090701 з вивчення профілактичного застосування препарату (n= 1)).
Рекомендації, пов’язані з допоміжними речовинами
ФЕЙБА 500 Од. та ФЕЙБА 1000 Од. містять 3,6 ммоль (80 мг) натрію (розрахункова величина) на флакон (із розрахунку приблизно 4 мг натрію на 1 мл). Це слід враховувати для пацієнтів, які перебувають на низьконатрієвій дієті.
З мікробіологічної точки зору препарат слід використати негайно, окрім випадків, коли метод відновлення препарату виключає ризик мікробного забруднення (контрольовані та валідовані асептичні умови). Якщо препарат відразу не використовується, відповідальність за терміни та умови зберігання препарату, готового до використання, покладається на користувача.
Відновлений препарат не слід зберігати у холодильнику.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
ФЕЙБА не має жодного впливу (або незначний) на здатність керувати автотранспортом або іншими механізмами.
Несумісність
Препарат ФЕЙБА не слід змішувати з іншими медичними препаратами, окрім розчинника, зазначеного у розділі «Спосіб застосування та дози».
Як з усіма препаратами коагуляції крові, ефективність і переносимість цього препарату може знизитися при змішуванні з іншими медичними препаратами. Рекомендується промити пристрій загального венозного доступу відповідним розчином, наприклад ізотонічним сольовим розчином, до і після введення препарату ФЕЙБА.
Фактори коагуляції, отримані з плазми крові людини, можуть адсорбуватися на внутрішній поверхні деяких видів пристроїв для ін’єкції/інфузії. Це може призвести до невдалого лікування. Тому з препаратом ФЕЙБА можна використовувати лише затверджені пластикові пристрої для інфузії.
Способ применения и дозы Фейба лиофил. пор. 500 ЕД фл., Раств. и набор д/раст. и введ.
Лікування потрібно розпочинати під контролем лікаря, який має відповідний досвід лікування подібних розладів коагуляції.
Дозування
Доза та тривалість лікування залежать від тяжкості порушення гемостазу, локалізації і сили кровотечі, а також клінічного стану хворого.
При виборі дози та частоти введення потрібно керуватися клінічною ефективністю у кожному конкретному випадку індивідуально.
Загалом рекомендується вводити препарат ФЕЙБА в дозі 50-100 одиниць на 1 кг маси тіла. При цьому не слід перевищувати разову дозу 100 Од./кг маси тіла і максимальну добову дозу 200 Од./кг маси тіла, окрім випадку, коли тяжкість кровотечі виправдовує використання вищих доз (див. розділ «Особливості застосування»).
Спонтанні кровотечі
Крововиливи в суглоби, м’язи і м’які тканини
У випадках кровотеч малої та середньої інтенсивності рекомендуються дози 50-75 Од./кг маси тіла кожні 12 годин. Лікування необхідно продовжувати до отримання чітких ознак клінічного покращення, наприклад зменшення болю, зниження припухлості або підвищення рухливості суглоба.
У випадках сильних крововиливів в м’язи і м’які тканини, наприклад, при заочеревинних гематомах, рекомендована доза становить 100 Од./кг маси тіла кожні 12 годин.
Кровотечі зі слизових оболонок
Рекомендується доза 50 Од./кг маси тіла кожні 6 годин при ретельному спостереженні за пацієнтом (візуальний контроль кровотечі, визначення динаміки гематокриту). Якщо кровотеча не припиняється, дозу можна збільшити до 100 Од./кг маси тіла, але при цьому не перевищувати максимальну добову дозу 200 Од./кг маси тіла.
Інші тяжкі кровотечі
При тяжкій кровотечі, такій як крововиливи в ЦНС, рекомендується доза 100 Од./кг маси тіла кожні 12 годин. В окремих випадках препарат ФЕЙБА можна вводити з інтервалом 6 годин до досягнення чіткого клінічного поліпшення. (При цьому не дозволяється перевищувати максимальну добову дозу 200 Од./кг маси тіла!)
Хірургічні втручання
При хірургічних втручаннях перед операцією може бути введена початкова доза 100 Од./кг маси тіла, а через 6-12 годин може бути введена ще одна доза 50-100 Од./кг. Як післяопераційну підтримуючу дозу можна ввести 50-100 Од./кг маси тіла з інтервалом 6-12 годин. Дозування, інтервали введення доз і тривалість лікування під час і після операції визначаються видом хірургічного втручання, загальним станом пацієнта і клінічною ефективністю у кожному окремому випадку. При цьому не дозволяється перевищувати максимальну добову дозу 200 Од./кг маси тіла.
Профілактика
- Профілактика кровотеч у пацієнтів з високими титрами інгібіторів і частими кровотечами після невдалої індукції імунної толерантності (ІІТ) або коли ІІТ не розглядається:
рекомендується доза 70-100 Од./кг маси тіла через день. За необхідності дозу можна збільшити до 100 Од/кг маси тіла на добу або поступово зменшувати.
- Профілактика кровотеч у пацієнтів з високими титрами інгібіторів під час індукції імунної толерантності (ІІТ):
препарат ФЕЙБА можна вводити разом з фактором VIII в дозі 50-100 Од./кг маси тіла двічі на добу, поки титр інгібіторів до фактора VIII не знизиться до <2 БО.*
* 1 БО (одиниця Бетезда) визначається як кількість антитіл, які інгібують 50 % активності фактора VIII у інкубованій плазмі крові (протягом 2 годин при 37 °С).
Застосування препарату ФЕЙБА особливим категоріям пацієнтів
Інформація стосовно пацієнтів, хворих на гемофілію В, з інгібіторами до фактора IX наведена у розділі «Фармакологічні властивості».
У комбінації з концентратом Фактора VIII препарат ФЕЙБА також використовувався у тривалій терапії для досягнення повного і постійного видалення інгібіторів до фактора VIII.
Контроль
У разі неадекватної відповіді на лікування препаратом рекомендується провести підрахунок кількості тромбоцитів, оскільки для ефективного застосування препарату необхідна достатня кількість функціонально інтактних тромбоцитів.
Через складний механізм дії прямий контроль діючих речовин неможливий. Коагуляційні тести, такі як час згортання цільної крові, тромбоеластограма (ТЕГ, величина r) і АЧТЧ, зазвичай показують незначне скорочення відповідних показників і не обов’язково корелюють з клінічною ефективністю. Тому зазначені тести мають обмежене значення для контролю терапії препаратом ФЕЙБА (див. розділ «Особливості застосування»).
Спосіб введення
Препарат необхідно розчинити, як описано нижче, і повільно вливати внутрішньовенно. Швидкість інфузії не повинна перевищувати 2 Од./кг маси тіла на хвилину.
Препарат ФЕЙБА потрібно розчинити безпосередньо перед введенням. Розчин потрібно використати негайно (препарат не містить жодних консервантів).
Обережно перемішуйте, поки весь препарат не розчиниться. Переконайтеся, що лікарський засіб повністю розчинився, інакше через фільтр пристрою пройде менше одиниць препарату ФЕЙБА.
Після розчинення приготовлений розчин необхідно візуально перевірити на наявність частинок і знебарвлення, перш ніж розпочинати введення. Не використовувати розчини, які є каламутними або містять осад.
Не використовувати повторно відкриті контейнери.
Не використовувати препарат, якщо його стерильна захисна система або пакування пошкоджені чи наявні ознаки псування.
Для розчинення використовують лише воду для ін’єкцій і пристрій для розчинення, що знаходиться в упаковці. У разі використання іншого пристрою потрібно використовувати фільтр з розміром пор не менше 149 мкм.
Будь-який невикористаний препарат або відходи знищити відповідно до місцевих правил.
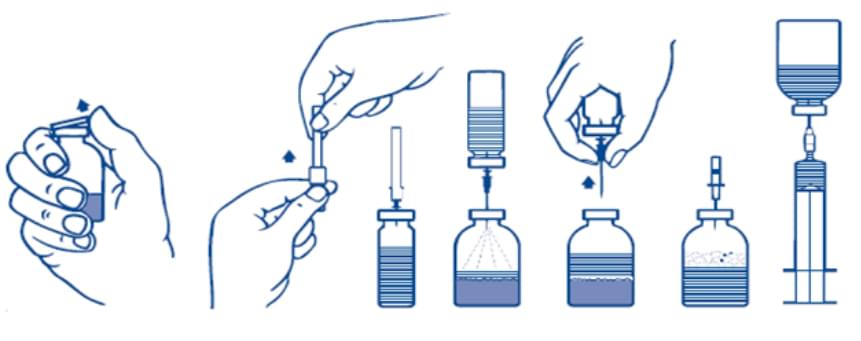
Розчинення порошку для приготування розчину для ін’єкцій за допомогою голок
1. Нагрівають закритий флакон з розчинником (водою для ін’єкцій) до кімнатної температури або температури не більше 37° С, якщо це необхідно.
2. Знімають захисні ковпачки з флакона з порошком і флакона з розчинником (рис. А) і дезінфікують гумові пробки обох флаконів.
3. Відкривають захисний ковпачок з одного кінця голки для перенесення, що входить у комплект, для чого прокручують і знімають його. Вставляють голку в гумову пробку флакона з розчинником (рис. Б і В).
4. Знімають захисний ковпачок з іншого кінця голки для перенесення, не торкаючись відкритого кінця!
5. Перевертають флакон з розчинником і вводять вільний кінець голки в цей флакон через гумову пробку флакона з порошком (рис. Г). Розчинник буде перетікати у флакон з порошком під дією вакууму.
6. Роз’єднують флакони, вийнявши голку для перенесення з флакона з порошком (рис. Ґ). Злегка струшують або покручують флакон з порошком для прискорення розчинення.
7. Після повного розчинення порошку вводять у флакон аераційну голку (рис. Д), що входить у комплект, для видалення піни. Виймають аераційну голку.
Інфузія
1. Відкривають один кінець захисного ковпачка з голки-фільтра, що входить у комплект, для чого прокручують і знімають його, і насаджують голку на стерильний одноразовий шприц. Набирають розчин у шприц (рис. Е).
2. Від’єднують голку-фільтр від шприца і повільно вводять розчин внутрішньовенно за допомогою комплекту для інфузії, що входить у комплект (або одноразової голки, що входить у комплект).
|
|
||||||
|
Рис. А |
Рис. Б |
Рис. В |
Рис. Г |
Рис. Ґ |
Рис. Д |
Рис. Е |
Розчинення порошку для приготування розчину для ін’єкцій за допомогою BAXJECT II
1. Нагрівають закритий флакон з розчинником (водою для ін’єкцій) до кімнатної температури (від 15 до 25 °С), наприклад, за допомогою водяної бані протягом кількох хвилин (не більше 37 °С), якщо це необхідно.
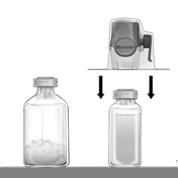
2. Знімають захисні ковпачки з флакона з порошком і флакона з розчинником та дезінфікують гумові пробки обох флаконів. Ставлять флакони на рівну поверхню.
3. Відкривають упаковку BAXJECT II, для чого зривають захисну плівку, не торкаючись вмісту упаковки (рис. а). Не виймайте пристосування для введення з упаковки.
4. Перевертають упаковку догори дном і вставляють прозоре пластикове вістря крізь пробку у флакон з розчинником (рис. б). Тепер знімають упаковку з BAXJECT II (рис. в). Не знімайте синю захисну кришку з BAXJECT II.
5. Коли BAXJECT II приєднаний до флакона з розчинником, перевертають їх так, щоб флакон з розчинником знаходився зверху. Натискають на пурпурне вістря BAXJECT II крізь флакон з препаратом ФЕЙБА. Вакуум у флаконі з препаратом ФЕЙБА затягне розчинник всередину (рис. г).
6. Обережно покручують, однак не трясуть систему, поки порошок не розчиниться. Перевіряють, щоб препарат повністю розчинився, інакше активний матеріал не пройде крізь фільтр.
|
Рис. а |
Рис. б |
Рис. в |
|
|
|
|
Інфузія
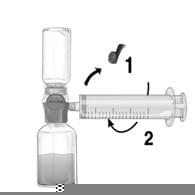
1. Знімають синю захисну кришку з BAXJECT II. Щільно приєднують шприц до BAXJECT II. НЕ ВТЯГУЙТЕ ПОВІТРЯ У ШПРИЦ (рис. ґ). Аби забезпечити щільне з’єднання між шприцом і BAXJECT II, рекомендується використовувати шприц з наконечником Люера (повертають шприц за годинниковою стрілкою до упору).
2. Перевертають систему так, щоб розчинений препарат знаходився зверху. Втягують розчинений препарат у шприц, для чого ПОВІЛЬНО тягнуть плунжер назад та перевіряють, щоб під час всього процесу втягування зберігалося щільне з’єднання між BAXJECT II і шприцом (рис. д).
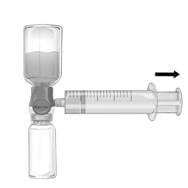
3. Від’єднують шприц.
4. У разі утворення піни препарату в шприці слід дочекатися зникнення піни. Повільно вводять розчин внутрішньовенно за допомогою комплекту для інфузії, що додається (або одноразової голки).
|
Рис. г |
Рис. ґ |
Рис. д
|
|
|
|
|
Не перевищуйте швидкість введення 2 Од. ФЕЙБА/кг маси тіла на хвилину.
Діти.
Досвід застосування препарату дітям віком до 6 років обмежений; то ж режим дозування, як і для дорослих, потрібно адаптувати до клінічного стану дитини.
Побочные реакции Фейба лиофил. пор. 500 ЕД фл., Раств. и набор д/раст. и введ.
Препарат ФЕЙБА може спричинити появу реакцій підвищеної чутливості алергічного типу, що включають кропив’янку, ангіоневротичний набряк, шлунково-кишкові розлади, бронхоспазм і падіння артеріального тиску; ці реакції можуть бути серйозними і системними (наприклад, анафілаксія з кропив’янкою і ангіоневротичним набряком, бронхоспазм і циркуляторний шок). Повідомлялося також про інші інфузійні реакції, такі як озноб, лихоманка і артеріальна гіпертензія.
Небажані реакції, представлені в цьому розділі, були зареєстровані в постмаркетинговий період, а також під час проведення двох досліджень із застосуванням препарату ФЕЙБА для лікування епізодів кровотечі у педіатричних і дорослих пацієнтів з гемофілією А або В та інгібіторами до факторів VIII або IX. До одного дослідження були також включені пацієнти з набутою гемофілією з інгібіторами до фактора VIII (2 із 49 пацієнтів).
Категорії частоти:
дуже часті >1/10;
часті >1/100 до <1/10;
нечасті >1/1000 до <1/100;
поодинокі >1/10000 до <1/1000;
рідкісні <1/10000;
невідомі – не можуть бути встановлені з наявних даних.
|
Клас системи органів (КСО) |
Побічні реакції |
Частота |
|
Розлади кровоносної і лімфатичної систем |
Синдром дисемінованого внутрішньосудинного згортання (ДВЗ-синдром), |
Невідомі |
|
підвищення титру інгібіторів (анамнестична відповідь)а |
||
|
Розлади імунної системи |
Реакція підвищеної чутливості |
Часті |
|
Кропив’янка, |
Невідомі |
|
|
анафілактична реакція |
||
|
Розлади нервової системи |
Парестезії, |
Невідомі |
|
гіпестезія, |
||
|
тромботичний інсульт, |
||
|
емболічний інсульт, сонливість, дисгевзія |
||
|
Головний більс, |
Часті |
|
|
запамороченняb |
||
|
Порушення серцевої діяльності |
Інфаркт міокарда, |
Невідомі |
|
тахікардія |
||
|
Судинні розлади |
Тромбоз, венозний тромбоз, артеріальний тромбоз, емболія (тромбоемболічні ускладнення), гіпертензія, приплив крові |
Невідомі |
|
Гіпотоніяс |
Часті |
|
|
Респіраторні, торакальні і медіастинальні розлади |
Легенева емболія, |
Невідомі |
|
бронхоспазм, |
||
|
свистяче дихання, |
||
|
кашель, |
||
|
задишка |
||
|
Шлунково-кишкові розлади |
Блювання, |
Невідомі |
|
діарея, |
||
|
відчуття дискомфорту в животі, |
||
|
нудота |
||
|
Ураження шкіри і підшкірної тканини |
Відчуття оніміння обличчя, |
Невідомі |
|
ангіоневротичний набряк, |
||
|
кропив’янка, |
||
|
свербіж |
||
|
Висипс |
Часті |
|
|
Загальні розлади та ураження в місці введення |
Біль у місці введення, |
Невідомі |
|
нездужання, |
||
|
відчуття жару, |
||
|
озноб, |
||
|
гіпертермія, |
||
|
біль у грудях, |
||
|
відчуття дискомфорту у грудній клітці |
||
|
Аналізи |
Падіння артеріального тиску |
Невідомі |
|
Позитивні антитіла до поверхневого антигену гепатиту Вс |
Часті |
а Підвищення титру інгібіторів (анамнестична відповідь) [непріоритетний термін згідно з MedDRA] – це підвищення попередньо існуючих титрів інгібіторів після введення препарату ФЕЙБА (див. розділ «Особливості застосування»).
b Побічні реакції на застосування препарату (ADR), про які повідомлялося у ході проведення первинних досліджень і досліджень, в яких вивчалося профілактичне застосування препарату. Частота, що вказується, − це частота, що визначалася в дослідженні профілактичного застосування препарату.
с Побічні реакції на застосування препарату (ADR), про які повідомлялося у ході проведення дослідження, в якому вивчалося профілактичне застосування препарату. Частота, що вказується, − це частота, що визначалася в дослідженні профілактичного застосування препарату.
Ефекти класу
Інші симптоми реакцій гіперчутливості, властиві для препаратів на основі плазми включають летаргію (млявість) і занепокоєння.
Передозировка Фейба лиофил. пор. 500 ЕД фл., Раств. и набор д/раст. и введ.
Ризик розвитку тромботичних і тромбоемболічних ускладнень (включаючи ДВЗ-синдром, інфаркт міокарда, венозний тромбоз і емболію легеневої артерії) може збільшуватися при застосуванні високих доз препарату ФЕЙБА. Деякі з представлених явищ спостерігалися при застосуванні препарату в дозах вище 200 Од./кг маси тіла або у пацієнтів з іншими факторами ризику розвитку тромбоемболічних явищ. У разі, якщо спостерігаються симптоми тромботичних і тромбоемболічних явищ, введення препарату слід негайно припинити та розпочати відповідні діагностичні і терапевтичні заходи (див. розділ «Особливості застосування»).
Применение в период беременности или кормления грудью Фейба лиофил. пор. 500 ЕД фл., Раств. и набор д/раст. и введ.
Пацієнти похилого віку
Наявні обмежені дані щодо застосування препарату ФЕЙБА у пацієнтів похилого віку.
Застосування у період вагітності або годування груддю.
Безпека використання препарату ФЕЙБА під час вагітності та годування груддю не встановлена.
Лікарі мають оцінити потенційні ризики від застосування препарату ФЕЙБА та призначати його лише тоді, коли це явно необхідно, беручи до уваги той факт, що при вагітності та у післяпологовий період існує підвищений ризик розвитку тромбоемболічних ускладнень, а також можливі деякі ускладнення вагітності, які пов’язані з підвищеним ризиком розвитку ДВЗ-синдрому.
Див. розділ Особливості застосування щодо детальної інформації про парвовірус В19.
Експерименти для дослідження впливу препарату ФЕЙБА на репродуктивну систему тварин не проводилися, наслідки впливу препарату ФЕЙБА на фертильність у ході проведення контрольованих клінічних досліджень встановлені не були.
Условия хранения Фейба лиофил. пор. 500 ЕД фл., Раств. и набор д/раст. и введ.
Термін придатності
Препарат – 2 роки.
Розчинник (вода для ін’єкцій) – 4 роки.
Хімічна і фізична стабільність розчиненого, готового до використання препарату, становить 3 години при кімнатній температурі не вище 25 °С .
Умови зберігання
Зберігати при кімнатній температурі не вище 25 °С. Не заморожувати. Захищати від дії світла.
Зберігати в недоступному для дітей місці.
Упаковка
По 1 флакону з порошком (по 500 Од. або 1000 Од.) у комплекті з 1 флаконом розчинника (вода для ін’єкцій по 20 мл) разом з набором для розчинення і введення (голка для перенесення, аераційна голка, голка-фільтр, голка-метелик, одноразова голка для ін’єкцій, одноразовий шприц) у картонній коробці.
Альтернативно до набору для розчинення і введення може застосовуватись пристосування BAXJECT II (для розведення без голок) та набором для введення (1 шприц ємністю 10 мл, 1 міні-набір для введення, 2 тампони спиртові, 2 пластирі).
Категорія відпуску
За рецептом.
Регистрационные данные Фейба лиофил. пор. 500 ЕД фл., Раств. и набор д/раст. и введ.
Производитель: Бакстер АГ, Австрія
Фарм. группа: Факторы свертывания крови.
Регистрация: UA/13036/01/01
МНН: Фактор коагуляції крові VIII з інгібітором актив.
Код АТХ:
(B) Лекарственные средства, влияющие на кроветворение и кровь
(B02) Противгеморрагические средства
(B02B) Витамин K и другие гемостатики
(B02BD) Фактор свертывания крови
(B02BD03) Ингибитор фактора свертывания крови VIII обходного действия
Дата обновления информации: 14.11.2023 г.
© likiteka 2025
- Биоклот А лиофилизат для р-ра д/ин. по 1000 мо во флак. №1 с р-лем, Біофарма Плазма, ТОВ, Україна
- Аимафикс пор. лиофил. д/п р-ра д/ин. 500 МЕ фл., С раств. во фл. 10 мл, Кедріон С.п.А, lталія
- Аимафикс пор. лиофил. д/п р-ра д/ин. 1000 МЕ фл., С раств. во фл. 10 мл, Кедріон С.п.А, lталія
- Адвейт пор. д/р-ра д/ин. 250 МЕ фл. 5 мл, с раств. (вода д/ин.) Фл. №1, Бакстер АГ, Австрія
- Адвейт пор. д/р-ра д/ин. 500 МЕ фл. 5 мл, с раств. (вода д/ин.) Фл. №1, Бакстер АГ, Австрія
- Адвейт пор. д/р-ра д/ин. 1000 МЕ фл. 5 мл, с раств. (вода д/ин.) Фл. №1, Бакстер АГ, Австрія
- Адвейт пор. д/р-ра д/ин. 1500 МЕ фл. 5 мл, с раств. (вода д/ин.) Фл. №1, Бакстер АГ, Австрія
- Адвейт пор. д/р-ра д/ин. 2000 МЕ фл. 5 мл, с раств. (вода д/ин.) Фл. №1, Бакстер АГ, Австрія
- Адвейт пор. д/р-ра д/ин. 3000 МЕ фл. 5 мл, с раств. (вода д/ин.) Фл. №1, Бакстер АГ, Австрія
- Бенефикс пор. д/р-ра д/ин. 250 МЕ фл., + Раств. шприц 5 мл, ст. набор №1, Ваєт Фарма С.А. для "Пфайзер Ейч. Сі. Пі. Корпорейшн", Іспанія/США
- Бенефикс пор. д/р-ра д/ин. 500 МЕ фл., + Раств. шприц 5 мл, ст. набор №1, Ваєт Фарма С.А. для "Пфайзер Ейч. Сі. Пі. Корпорейшн", Іспанія/США
- Бенефикс пор. д/р-ра д/ин. 1000 МЕ фл., + Раств. шприц 5 мл, ст. набор №1, Ваєт Фарма С.А. для "Пфайзер Ейч. Сі. Пі. Корпорейшн", Іспанія/США
- Бенефикс пор. д/р-ра д/ин. 2000 МЕ фл., + Раств. шприц 5 мл, ст. набор №1, Ваєт Фарма С.А. для "Пфайзер Ейч. Сі. Пі. Корпорейшн", Іспанія/США
- Биоклот А (Комплекс Антигемофильного Фактора Viii И Фактора Виллебранда) лиофил. д/р-ра д/ин. 125 МЕ фл., С раств. (вода д/ин.) Фл. 5 мл №1, Біофарма Плазма, ТОВ, Україна
- Биоклот А (Комплекс Антигемофильного Фактора Viii И Фактора Виллебранда) лиофил. д/р-ра д/ин. 200 МЕ фл., С раств. (вода д/ин.) Фл. 5 мл №1, Біофарма Плазма, ТОВ, Україна