Аранесп розчин д/ін., 100 мкг/мл по 0,3 мл у поперед. запов. шпр. №1
Амджен Європа Б.В., НідерландиСклад
діюча речовина: дарбепоетин альфа;
1 попередньо наповнений шприц містить дарбепоетину альфа:
10 мкг у 0,4 мл (25 мкг/мл);
30 мкг у 0,3 мл (100 мкг/мл);
500 мкг у 1 мл (500 мкг/мл);
допоміжні речовини: натрію хлорид, натрію дигідрофосфат моногідрат, натрію гідрофосфат безводний, полісорбат 80, вода для ін’єкцій.
Лікарська форма
Розчин для ін’єкцій.
Основні фізико-хімічні властивості: прозора, безбарвна рідина, практично без часточок.
Фармакотерапевтична група
Протианемічні, інші протианемічні засоби.
Код АTХ B03XA02.
Фармакологічні властивості
Фармакодинаміка.
Дарбепоетин альфа виготовляється шляхом генної технології із застосуванням клітин яєчників китайського хом’яка (CHO-K1).
Людський еритропоетин є ендогенним глікопротеїновим гормоном, який є первинним регулятором еритропоезу завдяки специфічній взаємодії з еритропоетиновим рецептором на еритроїдних клітинах-попередниках у кістковому мозку. Продукування еритропоетину переважно відбувається у нирках та регулюється ними у відповідь на зміни в оксигенації тканин. Продукування ендогенного еритропоетину є порушеним у пацієнтів з хронічною нирковою недостатністю, і основною причиною анемії у таких пацієнтів є дефіцит еритропоетину. В онкохворих пацієнтів, які отримують хіміотерапію, етіологія анемії є багатофакторною. У таких пацієнтів і дефіцит еритропоетину, і знижена відповідь еритроїдних клітин-попередників на ендогенний еритропоетин значно сприяють розвитку анемії.
Дарбепоетин альфа стимулює еритропоез завдяки тому ж самому механізму, що й ендогенний гормон. Дарбепоетин альфа має п’ять N-пов’язаних вуглеводних ланцюжків, тоді як ендогенний гормон та рекомбінантні людські еритропоетини (r-HuEPO) мають три. Додаткові залишки цукрів молекулярно не відрізняються від тих, що є на ендогенному гормоні. Через збільшений вміст вуглеводу дарбепоетин альфа має довший термінальний період напіввиведення, ніж r-HuEPO, а отже, і більшу активність in vivo. Незважаючи на ці молекулярні зміни, дарбепоетин альфа зберігає дуже вузьку специфічність до еритропоетинового рецептора.
Пацієнти із хронічною нирковою недостатністю
У рандомізованому, подвійному сліпому коригуючому дослідженні (n = 358) для порівняння одного прийому на 2 тижні та одного прийому на місяць у пацієнтів із хронічною нирковою недостатністю або пацієнтів, які перебувають на діалізі, прийом дарбепоетину альфа 1 раз на місяць не поступався одноразовому прийому на 2 тижні для корекції анемії. Середній час (квартиль 1, квартиль 3) досягнення корекції рівня гемоглобіну (збільшення на ≥ 100 г/л та ≥ 10 г/л від базового рівня) складав 5 тижнів для обох режимів, 1 раз на 2 тижні (3, 7 тижнів) та 1 раз на місяць (3, 9 тижнів). Протягом періоду дослідження (29-33 тижні) середній (95 % СІ) тижневий еквівалент дози становив 0,20 (0,17, 0,24) мкг/кг при режимі 1 раз на 2 тижні та 0,27 (0,23, 0,32) мкг/кг у режимі 1 раз на місяць.
В ході рандомізованого подвійного сліпого плацебо-контрольованого дослідження (TREAT) на когорті з 4 038 пацієнтів із ХНН, які не перебували на діалізі, з діабетом 2-го типу і з рівнем гемоглобіну ≤ 11 г/дл, пацієнти отримували або дарбепоетин альфа для досягнення рівня гемоглобіну 13 г/дл, або плацебо (із підтримуючим застосуванням дарбепоетину альфа при зниженні рівнів гемоглобіну нижче показника 9 г/дл). Дослідженню не вдалося досягти жодної зі своїх двох головних цілей – засвідчити зниження, з одного боку, ризику смертності з усіх причин або ризику серцево-судинної захворюваності (дарбепоетин альфа у порівнянні з плацебо; ВР = 1,05; 95 % ДІ (0,94; 1,17)) та, з іншого боку – ризику смертності з усіх причин або кінцевої стадії ниркової недостатності (КСНН) (дарбепоетин альфа у порівнянні з плацебо; ВР = 1,06; 95 % ДІ (0,95; 1,19)). Аналіз окремих компонентів комбінованих кінцевих точок виявив такі показники ВР (95 % ДІ): летальні випадки – 1,05 (0,92; 1,21), застійна серцева недостатність (ЗСН) – 0,89 (0,74; 1,08), інфаркт міокарду (ІМ) – 0,96 (0,75; 1,23), інсульт – 1,92 (1,38; 2,68), шпиталізація з причини ішемії міокарду – 0,84 (0,55; 1,27), КСНН – 1,02 (0,87; 1,18).
Онкохворі пацієнти, які отримують хіміотерапію
Виживання пацієнтів і прогресування пухлин вивчалося в ході п'яти великих контрольованих досліджень із залученням когорти загальною чисельністю 2 833 пацієнти. Чотири з цих п'яти досліджень були подвійними сліпими плацебо-контрольованими дослідженнями і одне – дослідженням відкритого типу. До двох досліджень залучалися такі пацієнти, які отримували хіміотерапію. У двох з цих досліджень цільовий рівень гемоглобіну становив > 13 г/дл, у решті досліджень – 12?14 г/дл. У дослідженні відкритого типу не було виявлено відмінності показників загального виживання пацієнтів, які отримували рекомбінантний людський еритропоетин, і пацієнтів контрольної групи. У чотирьох плацебо-контрольованих дослідженнях показники відношення ризиків для загального виживання знаходилися у діапазоні від 1,25 до 2,47 на користь контролю. Результати цих досліджень засвідчили незрозуміле чітке статистично значуще перевищення показників смертності серед пацієнтів з анемією, пов'язаною з різними типами звичайного раку, які приймали рекомбінантний людський еритропоетин, у порівнянні з контролем. Отриманий в рамках цих випробувань результат загального виживання не вдалося обґрунтовано пояснити відмінністю показників частоти випадків тромбозу і споріднених ускладнень у пацієнтів, які отримували рекомбінантний людський еритропоетин, і у пацієнтів контрольної групи.
Було також здійснено систематичний огляд, що охоплював понад 9 000 онкохворих пацієнтів, які брали участь у 57 клінічних дослідженнях. Мета-аналіз даних загального виживання дозволив розрахувати показник відношення ризиків, що становив 1,08 на користь групи контролю (95 % ДІ (0,99; 1,18); 42 дослідження і 8 167 пацієнтів).
Фармакокінетика.
Через підвищений вміст вуглеводу рівень дарбепоетину альфа у кровообігу залишається більшим за мінімальну стимулюючу концентрацію, необхідну для еритропоезу, протягом більшого часу, ніж еквівалентна молярна доза r-HuEPO, що дозволяє з меншою частотою застосовувати дарбепоетин альфа для досягнення такої ж біологічної відповіді.
Пацієнти з хронічною нирковою недостатністю
Фармакокінетику дарбепоетину альфа вивчали клінічно на пацієнтах із хронічною нирковою недостатністю після внутрішньовенного та підшкірного застосування. При внутрішньовенному застосуванні термінальний період напіввиведення дарбепоетину альфа становить 21 годину (SD 7,5). Кліренс дарбепоетину альфа становить 1,9 мл/год/кг (SD 0,56), а об’єм розподілу (Vss) є приблизно рівним об’єму у плазмі крові (50 мл/кг). Біодоступність становить 37 % при підшкірному застосуванні. Після щомісячного застосування дарбепоетину альфа при підшкірних дозах у межах 0,6-2,1 мкг/кг термінальний період напіввиведення становив 73 години (SD 24). Довший термінальний період напіввиведення дарбепоетину альфа, введеного підшкірно порівняно з внутрішньовенним введенням, є зумовленим кінетикою підшкірної абсорбції. У клінічних дослідженнях спостерігалася мінімальна акумуляція незалежно від шляху введення. У доклінічних дослідженнях було продемонстровано, що нирковий кліренс мінімальний (до 2 % від загального кліренсу) та не впливає на період напіввиведення з сироватки крові.
Фармакокінетика дарбепоетину альфа є однаковою для дітей та дорослих пацієнтів із ХНН. Після внутрішньовенного застосування спостерігалася приблизно 25 % різниця між дітьми та дорослими пацієнтами у площі під кривою від часу 0 до безкінечності (AUC[0?∞]); проте ця різниця була у два рази меншою меж у AUC(0-∞), що спостерігалися у дітей. AUC(0-∞) була однаковою у дорослих та дітей з ХНН після підшкірного застосування. Період напіввиведення також був однаковим у дорослих та дітей з ХНН після внутрішньовенного та підшкірного застосування.
Онкохворі пацієнти, які отримують хіміотерапію
Після підшкірного введення 2,25 мкг/кг дорослим онкохворим пацієнтам середня максимальна концентрація дарбепоетину альфа 10,6 нг/мл (SD 5,9) досягалася за середній час 91 годину (SD 19,7). Ці параметри відповідали лінійній фармакокінетиці у широких межах дози (0,5-8 мкг/кг щотижня та 3-9 мкг/кг кожні 2 тижні). Фармакокінетичні параметри не змінювалися при багаторазовому застосуванні доз протягом 12 тижнів (застосування дози кожного тижня або кожні 2 тижні). Спостерігалося очікуване помірне (< 2 рази) підвищення концентрації у сироватці крові при наближенні до рівноважного стану, проте не спостерігалося неочікуваної акумуляції після багаторазового застосування. Було проведено фармакокінетичне дослідження на пацієнтах з анемією, спричиненою хіміотерапією, яких лікували 6,75 мкг/кг дарбепоетину альфа, які застосовували підшкірно кожні 3 тижні у комбінації з хіміотерапією. У цьому дослідженні, яке дозволило детально охарактеризувати термінальний період напіввиведення, середній (SD) термінальний період напіввиведення становив 74 (SD 27) години.
Показання Аранесп розчин д/ін., 100 мкг/мл по 0,3 мл у поперед. запов. шпр. №1
Лікування симптоматичної анемії, пов’язаної з хронічною нирковою недостатністю (ХНН) у дорослих та дітей віком від 11 років.
Лікування симптоматичної анемії у дорослих онкохворих пацієнтів з немієлоїдними злоякісними утвореннями, які отримують хіміотерапію.
Протипоказання Аранесп розчин д/ін., 100 мкг/мл по 0,3 мл у поперед. запов. шпр. №1
Підвищена чутливість до діючої речовини або до будь-якої з допоміжних речовин препарату, що вказані в розділі «Склад».
Артеріальна гіпертензія, яка не піддається адекватному контролю лікарськими засобами.
Особливі заходи безпеки
При амбулаторному застосуванні Аранесп можна тільки 1 раз дістати з холодильника та зберігати його при кімнатній температурі (до 25 °C) протягом 7 діб. Після того, як шприц дістали з холодильника та він досяг кімнатної температури (до 25 °C), його слід або використати протягом 7 днів, або викинути.
Аранесп є стерильним, але не законсервованим продуктом. Не застосовувати більше однієї дози на шприц. Будь-які залишки лікарського засобу у попередньо наповненому шприці слід викинути.
Перед застосуванням розчин Аранеспу необхідно оглянути на наявність механічних часточок та наявність забарвлення. Не застосовувати препарат при наявності механічних часточок та появі забарвлення. Не струшувати. Перед ін’єкцією дати попередньо наповненому шприцу нагрітися до кімнатної температури.
Слід змінювати ділянку введення та вводити ін’єкцію повільно, щоб уникнути дискомфорту у ділянці введення.
Невикористаний медичний продукт та залишки матеріалів слід утилізувати згідно з місцевими вимогами.
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Клінічні результати, отримані на цей час, не вказують на будь-яку взаємодію дарбепоетину альфа з іншими речовинами. Проте існує потенціал взаємодії з препаратами, що значною мірою зв’язуються з червоними клітинами крові, наприклад циклоспорин, такролімус. Якщо Аранесп застосовувати одночасно з будь-яким із цих препаратів, слід стежити за рівнем цих препаратів у крові та корегувати дозу при зростанні концентрації гемоглобіну.
Загальні застереження
Для покращення спостереження за препаратами, які стимулюють еритропоез (ПСЕ), торгову назву препарату необхідно чітко записати в історію хвороби пацієнта.
У всіх пацієнтів слід контролювати артеріальний тиск, особливо на початку терапії Аранеспом. Якщо артеріальний тиск важко піддається контролю за допомогою відповідних заходів, гемоглобін можна знизити, зменшуючи або відмінивши дозу Аранеспу (див. розділ «Спосіб застосування та дози»). У пацієнтів з ХНН при застосуванні Аранеспу спостерігалися випадки важкої гіпертензії, включаючи гіпертонічний криз, гіпертонічну енцефалопатію та судоми.
Для забезпечення ефективного еритропоезу перед початком та під час терапії у всіх пацієнтів слід оцінювати кількість заліза, а в деяких випадках може виникнути необхідність у допоміжній терапії залізом.
У разі відсутності реакції на терапію Аранеспом слід визначити причинні фактори. Дефіцит заліза, фолієвої кислоти або вітамінуВ12 знижує ефективність препаратів, що стимулюють еритропоез, а тому його слід корегувати. Супутні інфекції, запалення або травми, приховані кровотечі, гемоліз, важка інтоксикація алюмінієм, існуючі гематологічні захворювання або фіброз кісткового мозку також можуть зменшити еритропоетичну відповідь. Як складову оцінки слід розглядати визначення кількості ретикулоцитів. Якщо після виключення характерних причин, що зумовлюють відсутність відповіді, у пацієнта спостерігається ретикулоцитопенія, слід розглянути необхідність обстеження кісткового мозку. Якщо кістковий мозок відповідає тесту на PRCA, слід провести аналіз на антитіла до еритропоетину.
Повідомлялося про асоційовані з лікуванням епоетином серйозні побічні реакції з боку шкіри та підшкірної тканини, включаючи синдром Стівенса– Джонсона та токсичний епідермальний некроліз, які можуть бути небезпечними для життя у т.ч. летальними. Більш тяжкі випадки спостерігались при терапії епоетинами тривалої дії.
Під час призначення препарату пацієнтів слід проінформувати про можливі симптоми, а також стежити за реакціями з боку шкіри та підшкірної тканини. Якщо з'являються ознаки, що свідчать про такі реакції, терапію Аранеспом слід негайно припинити і розглянути альтернативне лікування.
Якщо у пацієнта розвинулась серйозна побічна реакція з боку шкіри та підшкірної тканини, така як синдром Стівенса– Джонсона або токсичний епідермальний некроліз, внаслідок застосування препарату Аранесп, лікування препаратом не слід поновлювати будь-коли в майбутньому.
Існують повідомлення про істинну еритроцитарну аплазію, спричинену нейтралізуючими антитілами до еритропоетину, яка асоціювалася з рекомбінантними еритропоетичними білками, включаючи Аранесп. Переважно повідомлялося про такі випадки у пацієнтів з ХНН, яких лікували підшкірно. Було продемонстровано, що ці антитіла мають перехресну реактивність з усіма еритропоетичними білками, а отже, пацієнтів з підозрюваною або підтвердженою наявністю нейтралізуючих антитіл не слід переводити на Аранесп (див. розділ «Побічні реакції»).
Парадоксальне зменшення гемоглобіну та розвиток важкої форми анемії, пов’язані з низькими кількостями ретикулоцитів, потребує негайного припинення лікування епоетином і проведення тестування протиеритропоетинового антитіла. Повідомлялося про випадки для пацієнтів з гепатитомС, які одержували інтерферон та рибавірин із супутнім призначенням епоетинів. Епоетини не застосовувати для лікування анемії, пов’язаної з гепатитомС.
Захворювання печінки в активній фазі було критерієм виключення в усіх дослідженнях Аранеспу, тому не існує даних для пацієнтів з порушенням функції печінки. Оскільки печінка вважається основним шляхом виведення дарбепоетину альфа та r?HuEPO, Аранесп слід з обережністю застосовувати пацієнтам із захворюваннями печінки.
Також Аранесп слід застосовувати з обережністю пацієнтам із серпоподібноклітинною анемією.
Неналежне застосування препарату здоровими людьми може призвести до надмірного збільшення гематокриту, що в свою чергу може бути пов’язане з виникненням небезпечних для життя ускладнень з боку серцево?судинної системи.
Ковпачок голки попередньо наповненого шприца містить сухий натуральний каучук (похідну латексу), який може спричинити алергічні реакції.
Слід з обережністю застосовувати Аранесп пацієнтам з епілепсією. Повідомлялося про судоми у пацієнтів, які застосовують Аранесп.
Необхідно ретельно зіставити заявлений ризик виникнення судинних ускладнень тромботичного характеру (TVE) з користю від лікування дарбепоетином альфа, особливо в пацієнтів з факторами ризику виникнення судинних ускладнень тромботичного характеру в анамнезі, у тому числі з ожирінням та попередніми епізодами TVE (наприклад, тромбоз глибоких вен, тромбоемболія легеневої артерії та інсульт).
Цей лікарський засіб містить менше ніж 1ммоль натрію (23мг) в дозі, тобто майже не містить натрію.
Пацієнти з хронічною нирковою недостатністю
У пацієнтів із хронічною нирковою недостатністю поточна концентрація гемоглобіну не повинна перевищувати верхню межу цільової концентрації гемоглобіну, рекомендованої у розділі «Спосіб застосування та дози». У клінічних дослідженнях спостерігався підвищений ризик летального випадку, тяжкі серцево?судинні або цереброваскулярні явища, включаючи інсульт, та тромбоз судин при застосуванні препаратів, що стимулюють еритропоез, для досягнення рівня гемоглобіну понад 12г/дл(7,5ммоль/л).
Слід проявляти обережність при підвищенні дози препарату Аранесп хворим із хронічною нирковою недостатністю, оскільки високі сумарні дози епоетину можуть підвищувати ризик смертності, серйозних серцево?судинних та цереброваскулярних ускладнень. У хворих зі слабкою відповіддю гемоглобіну на епоетин слід враховувати альтернативні причини слабкої відповіді (див. розділи «Фармакодинаміка» та «Спосіб застосування та дози»).
Контрольовані клінічні дослідження не показали значних переваг, які б можна було віднести на рахунок застосування епоетинів при зростанні концентрації гемоглобіну вище рівня, необхідного для контролю симптомів анемії або для уникнення переливання крові.
Усім пацієнтам з показниками феритину сироватки нижче 100мкг/л або тим, у кого насичення трансферину є нижчим за 20%, рекомендується допоміжна терапія залізом.
Під час терапії Аранеспом слід регулярно стежити за рівнем калію в сироватці. Повідомлялося про підвищення рівня калію у кількох пацієнтів, які отримували Аранесп, проте причинний зв'язок не встановлено. Якщо спостерігається підвищений або зростаючий рівень калію, слід розглянути питання щодо необхідності припинити застосування Аранеспу, поки рівень не буде відкореговано.
Онкохворі пацієнти
Вплив на ріст пухлини
Епоетини є факторами росту, що головним чином стимулюють продукування червоних клітин крові. Рецептори еритропоетину можуть виявлятися на поверхні різних пухлинних клітин. Як і у випадку з усіма факторами росту, існує припущення, що епоетини можуть стимулювати ріст пухлин. У кількох контрольованих дослідженнях не було продемонстровано, що епоетини покращують загальне виживання або знижують ризик прогресування пухлини у пацієнтів з анемією, яка була асоційована з раком.
Контрольовані клінічні дослідження, в яких застосовували Аранесп та інші препарати, що стимулюють еритропоез, продемонстровали:
· скорочений час до прогресування пухлини у пацієнтів з поширеним раком голови та шиї, які отримують радіотерапію, при застосуванні цих препаратів до досягнення заданої концентрації гемоглобіну більше 14г/дл(8,7ммоль/л); препарати, що стимулюють еритропоез, не показані для застосування цій категорії пацієнтів.
· скорочення загального виживання та збільшення кількості летальних випадків, які відносять на рахунок прогресування захворювання за 4місяці, у пацієнтів із метастазуючим раком молочних залоз, які отримують хіміотерапію, при застосуванні цих препаратів до досягнення заданої концентрації гемоглобіну 12?14г/дл(7,5?8,7ммоль/л).
· підвищений ризик летальних випадків при застосуванні цих препаратів до досягнення заданої концентрації гемоглобіну 12г/дл(7,5ммоль/л) у пацієнтів з активним злоякісним захворюванням, які не отримують ані хіміотерапії, ані радіотерапії. Препарати, що стимулюють еритропоез, не показані для застосування цій категорії пацієнтів.
· виявлене підвищення ризику ПЗ або смерті на 9% у групі застосування епоетину альфа в поєднанні зі стандартним лікуванням порівняно з первинним аналізом та 15% підвищення ризику, яке не вдається статистично виключити, у пацієнтів з метастазуючим раком молочних залоз, які отримують хіміотерапію, при застосуванні цих препаратів для досягнення рівня концентрації гемоглобіну від 10 до 12г/дл (6,2?7,5ммоль/л).
· не меншу ефективність дарбепоетину альфа в порівнянні з плацебо за загальним показником виживаності та виживаності без прогресування захворювання в пацієнтів із прогресуючим недрібноклітинним раком легень, які отримують хіміотерапію, при застосуванні цих препаратів для досягнення цільової концентрації гемоглобіну 12г/дл (7,5ммоль/л) (див. розділ «Фармакодинаміка»).
Зважаючи на вищезазначене, у деяких клінічних ситуаціях для лікування анемії в онкохворих пацієнтів слід надавати перевагу переливанню крові. Рішення щодо застосування рекомбінантних еритропоетинів має базуватися на оцінці співвідношення «користь/ризик» у кожного конкретного пацієнта, при проведенні якої слід враховувати специфічний клінічний контекст. Фактори, які слід враховувати при проведенні оцінки, включають тип пухлини та її стадію, ступінь анемії, імовірну тривалість життя, середовище, у якому лікується пацієнт, а також переваги пацієнта (див. розділ «Фармакологічні властивості»).
У пацієнтів із твердими пухлинами або лімфопроліферативними злоякісними новоутвореннями, якщо значення гемоглобіну перевищують 12г/дл(7,5ммоль/л), слід ретельно дотримуватися рекомендацій щодо адаптації дози, наведених у розділі «Спосіб застосування та дози», щоб мінімізувати потенційний ризик тромбоемболічних явищ. Також слід регулярно визначати рівні тромбоцитів та гемоглобіну.
Особливості застосування
При амбулаторному застосуванні Аранесп можна тільки 1раз дістати з холодильника та зберігати його при кімнатній температурі (до 25°C) протягом 7діб. Після того, як шприц дістали з холодильника та він досяг кімнатної температури (до 25°C), його слід або використати протягом 7днів, або викинути.
Аранесп є стерильним, але не законсервованим продуктом. Не застосовувати більше однієї дози на шприц. Будь-які залишки лікарського засобу у попередньо наповненому шприці слід викинути.
Перед застосуванням розчин Аранеспу необхідно оглянути на наявність механічних часточок та наявність забарвлення. Не застосовувати препарат при наявності механічних часточок та появі забарвлення. Не струшувати. Перед ін’єкцією дати попередньо наповненому шприцу нагрітися до кімнатної температури.
Невикористаний медичний продукт та залишки матеріалів слід утилізувати згідно з місцевими вимогами.
Інструкції щодо введення Аранеспу
У цьому розділі містяться вказівки щодо самостійного введення Аранеспу. Пам’ятайте, що вводити собі ін’єкції можна лише після того, як ваш лікар, медсестра чи фармацевт покажуть вам, як це потрібно робити. Якщо вам щось незрозуміло відносно техніки проведення ін’єкцій, запитайте свого лікаря, медсестру чи фармацевта.
Як правильно користуватися попередньо наповненим шприцом з Аранеспом?
Ваш лікар призначив вам підшкірну ін’єкцію Аранеспу, що міститься в попередньо наповненому шприці. Ваш лікар, медсестра чи фармацевт скаже вам, скільки Аранеспу вам потрібно і як часто необхідно робити ін’єкції.
Обладнання
Щоб самостійно зробити собі ін’єкцію, вам знадобиться:
· новий попередньо наповнений шприц з Аранеспом;
· спиртові або аналогічні серветки.
Що потрібно зробити перед підшкірною ін’єкцією Аранеспу?
1. Вийняти попередньо наповнений шприц із холодильника. Залишити попередньо наповнений шприц при кімнатній температурі приблизно на 30хвилин. Це зробить ін’єкцію комфортнішою. У жодному разі не підігрівати Аранесп в інший спосіб (наприклад, у мікрохвильовій печі або гарячій воді). Крім того, не залишати шприц під впливом прямого сонячного світла.
2. Не струшувати попередньо наповнений шприц.
3. Не знімати ковпачок зі шприца, доки все не буде готово для виконання ін’єкції.
4. Слід переконатися, що доза відповідає призначенням лікаря.
5. Слід перевірити термін придатності на етикетці попередньо наповненого шприца (EXP). Не використовувати його, якщо минув останній день зазначеного місяця.
6. Слід перевірити зовнішній вигляд Аранеспу. Це має бути прозора безбарвна або злегка перламутрова рідина. Не застосовувати препарат при наявності муті або механічних часточок.
7. Ретельно вимити руки.
8. Знайти зручну, добре освітлену поверхню та покласти на неї все необхідне обладнання в межах доступу.
Як підготуватися до ін’єкції Аранеспу?
Перед ін’єкцією необхідно виконати такі дії:
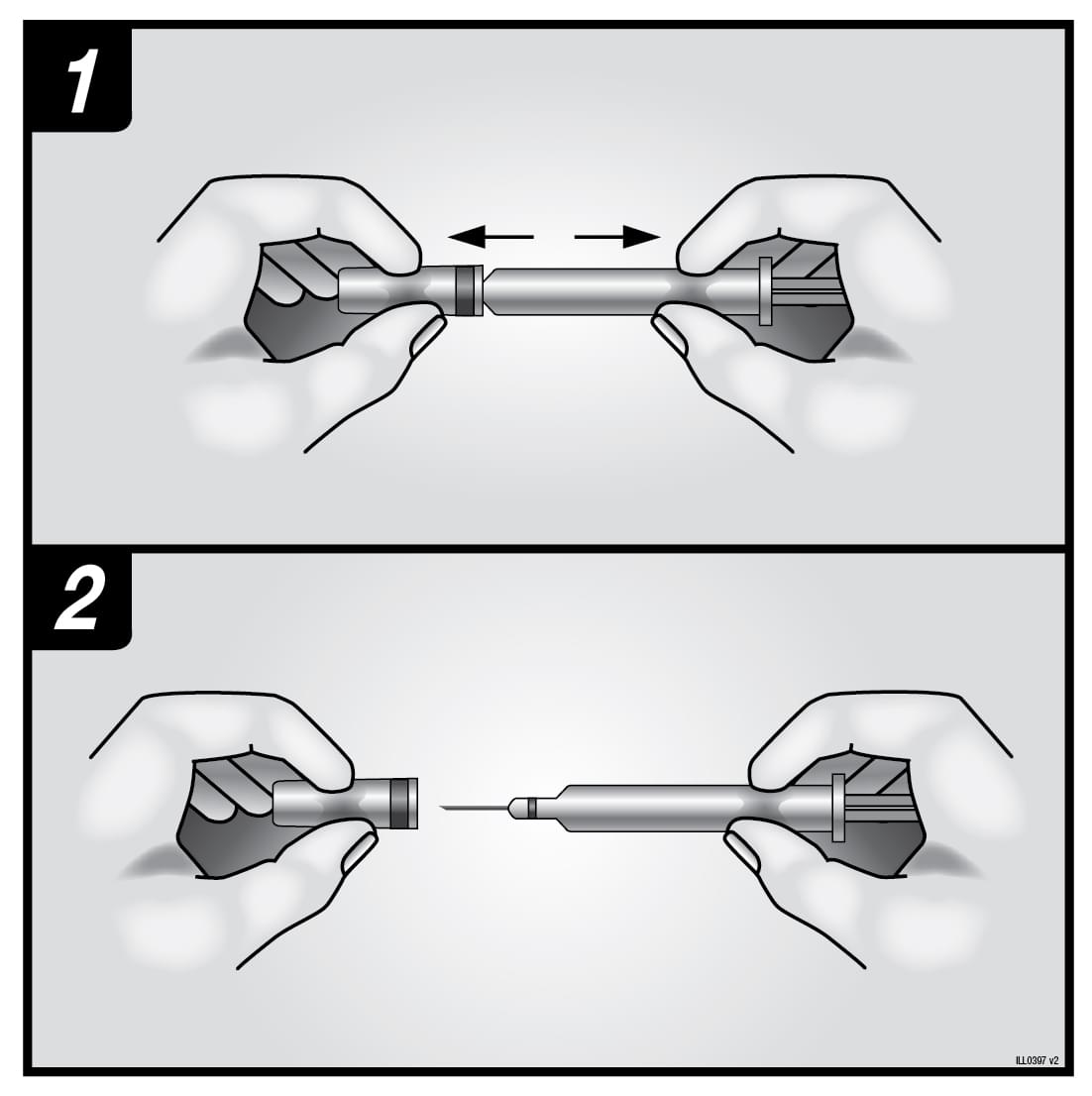
|
1. Щоб уникнути згинання голки, обережно зняти ковпачок з голки, не викручуючи його, як показано на рисунках1 та2. 2. Не торкатися голки та не штовхати поршень. 3. У попередньо наповненому шприці може бути маленька бульбашка повітря. Вам не слід видаляти її перед введенням ін’єкції. Введення розчину з бульбашкою повітря є нешкідливим. 4. Тепер можна застосувати попередньо наповнений шприц. |
|
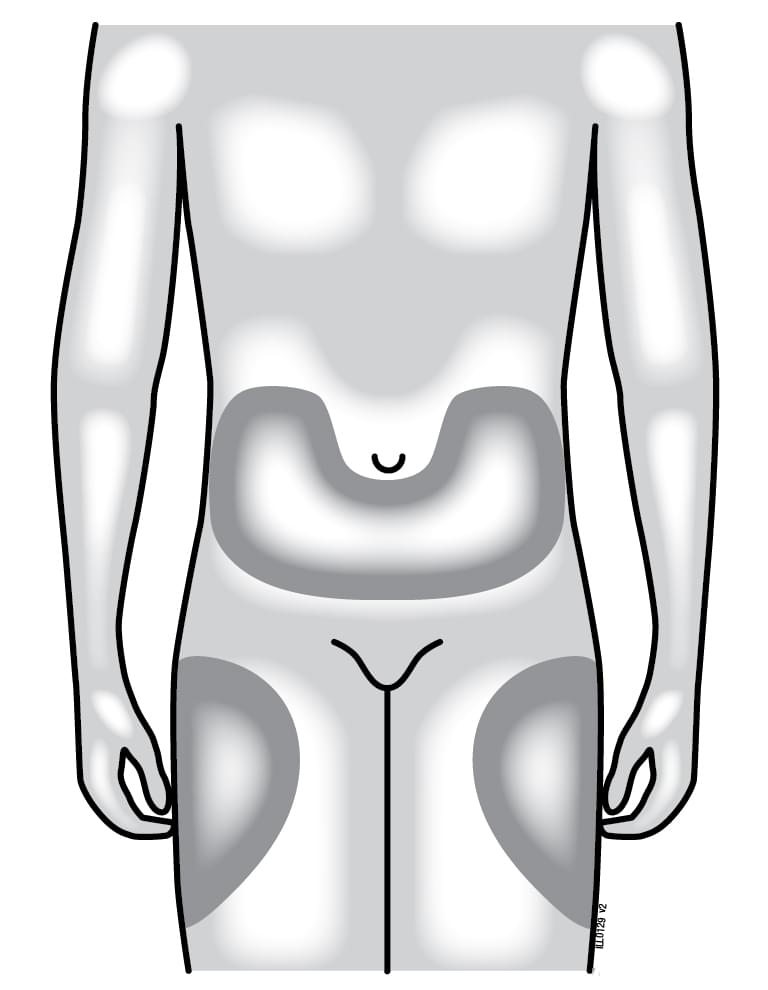
Куди слід робити ін’єкцію?
|
|
Найкращими ділянками для самостійного виконання ін’єкцій є верхні частини стегон і живіт. Якщо ін’єкцію робить хтось інший, можна також використовувати задню поверхню рук. Якщо місце ін’єкції почервоніло або подразнене, ділянку введення ін’єкції можна змінити. |
Як зробити собі ін’єкцію?
1. Продезінфікувати шкіру за допомогою тампона зі спиртом та захопити шкіру (без надавлювання) великим і вказівним пальцями.
2. Повністю ввести голку в шкіру, як показував лікар, медсестра або фармацевт.
3. Підшкірно ввести необхідну дозу, як показував лікар, медсестра або фармацевт.
4. Повільно та рівномірно натискати на поршень, утримуючи шкіру між великим і вказівним пальцями, доки шприц не спорожніє.
5. Витягнути голку та відпустити шкіру.
6. Якщо в місці ін’єкції з’явилася крапля крові, її можна обережно видалити ватною кулькою або марлевим тампоном. Не терти місце ін’єкції. Якщо необхідно, місце ін’єкції можна закрити пластирем.
7. Застосовувати кожен шприц лише для однієї ін’єкції. Не використовувати залишки Аранеспу, що залишилися в шприці.
Пам’ятайте!У разі виникнення будь-яких проблем не бійтеся попросити свого лікаря чи медсестру про допомогу та пораду.
Утилізація шприців
· Не закривати ковпачками для голки використані шприци, оскільки ви можете випадково вколотися.
· Зберігайте використані шприци в недоступних для дітей місцях і поза поля зору дітей.
· Використані попередньо наповнені шприци слід утилізувати згідно з місцевими вимогами. Запитайте свого фармацевта, як правильно утилізувати непотрібні лікарські засоби. Це допоможе захистити довкілля.
Несумісність
При відсутності досліджень несумісності цей лікарський засіб не слід змішувати або застосовувати як інфузію з іншими лікарськими засобами.
Спосіб застосування та дози Аранесп розчин д/ін., 100 мкг/мл по 0,3 мл у поперед. запов. шпр. №1
Лікування Аранеспом проходить лише під контролем лікаря, який має досвід лікування зазначених вище показань.
Аранесп постачається готовим для застосування у попередньо наповнених шприцах. Вказівки щодо застосування, поводження та утилізації наведені у розділі «Особливі заходи безпеки».
Лікування симптоматичної анемії у дорослих та дітей з хронічною нирковою недостатністю
Симптоми та наслідки анемії можуть варіюватися залежно від віку, статі та загальної тяжкості захворювання; необхідно, щоб лікар оцінив індивідуальний перебіг захворювання та стан пацієнта. Для підвищення гемоглобіну до рівня не більше 120 г/л Аранесп слід вводити підшкірно або внутрішньовенно. Пацієнтам, які не отримують гемодіаліз, препарат рекомендується вводити підшкірно, щоб уникнути проколювання периферичних вен.
Через наявність варіабельності між пацієнтами іноді у пацієнта можуть спостерігатися індивідуальні значення гемоглобіну, що є нижчими та вищими за бажаний рівень гемоглобіну. Варіабельність гемоглобіну слід контролювати шляхом підбору дози з урахуванням цільових меж гемоглобіну від 100 до 120 г/л. Слід уникати тривалого рівня гемоглобіну понад 120 г/л; інформація щодо відповідного корегування дози у випадках, коли спостерігаються значення гемоглобіну, що перевищують 120 г/л, викладена нижче. Слід уникати підйому гемоглобіну більш ніж на 20 г/л за чотиритижневий період. Якщо це трапиться, слід провести відповідне корегування дози, як зазначено.
Лікування Аранеспом поділяється на два етапи – корекція та підтримуюча фаза. Вказівки надаються окремо для дорослих та пацієнтів дитячого віку.
Дорослі пацієнти з хронічною нирковою недостатністю
Фаза корекції
Початкова доза, яку вводять підшкірно або внутрішньовенно, становить 0,45 мкг/кг маси тіла одноразовою ін’єкцією 1 раз на тиждень. Альтернативно пацієнтам, які не перебувають на діалізі, можна підшкірно вводити послідовні початкові дози одноразовою ін’єкцією: 0,75 мкг/кг 1 раз кожні 2 тижні або 1,5 мкг/кг 1 раз на місяць. Якщо підвищення рівня гемоглобіну є недостатнім (менше 10 г/л за 4 тижні), слід збільшити дозу приблизно на 25 %. Не слід збільшувати дозу частіше ніж 1 раз кожні 4 тижні.
Якщо підвищення гемоглобіну становить понад 20 г/л за 4 тижні, дозу слід зменшити приблизно на 25 %. Якщо рівень гемоглобіну перевищує 120 г/л, слід розглянути необхідність зменшити дозу. Якщо рівень гемоглобіну продовжує зростати, дозу слід зменшити приблизно на 25 %. Якщо після зменшення дози гемоглобін продовжує зростати, дозу слід тимчасово відмінити, поки гемоглобін не почне знижуватися, а в цей момент терапію слід розпочати знову при дозі, що є приблизно на 25 % нижчою за попередню.
Рівень гемоглобіну слід вимірювати кожні 1-2 тижні, доки він не стабілізується. Після цього рівень гемоглобіну можна вимірювати через більші інтервали.
Підтримуюча фаза
Пацієнтам, які перебувають на діалізі, можна продовжувати застосовувати Аранесп як одноразову ін’єкцію 1 раз на тиждень або 1 раз кожні 2 тижні. Пацієнти, які перебувають на діалізі, яких переводять з режиму дозування Аранеспу 1 раз на тиждень на режим дозування через тиждень, мають спочатку отримати дозу, вдвічі більшу за попередню дозу, яку вводили 1 раз на тиждень.
Пацієнтам, які не перебувають на діалізі, можна продовжувати застосовувати Аранесп як одноразову ін’єкцію 1 раз на тиждень, 1 раз кожні 2 тижні або 1 раз на місяць. Пацієнтам, які застосовують Аранесп 1 раз на 2 тижні, після досягнення бажаного рівня гемоглобіну Аранесп можна вводити підшкірно 1 раз на місяць, застосовуючи початкову дозу, що вдвічі перевищує попередню дозу, яку вводили 1 раз кожні 2 тижні.
Дозу слід титрувати відповідно до необхідності для підтримання бажаного рівня гемоглобіну.
Якщо для підтримання гемоглобіну на бажаному рівні потрібне корегування дози, рекомендується корегувати дозу приблизно на 25 %.
Якщо підвищення гемоглобіну становить понад 20 г/л за 4 тижні, дозу слід зменшити приблизно на 25 % залежно від швидкості підвищення. Якщо рівень гемоглобіну перевищує 120 г/л, слід розглянути питання щодо необхідності зменшити дозу. Якщо рівень гемоглобіну продовжує зростати, дозу слід зменшити приблизно на 25 %. Якщо після зменшення дози гемоглобін продовжує зростати, дозу слід тимчасово відмінити, поки гемоглобін не почне знижуватися, а в цей момент терапію слід розпочати знову при дозі, що є приблизно на 25 % нижчою за попередню.
Слід ретельно стежити за пацієнтами, щоб упевнитися у тому, що для забезпечення адекватного контролю за симптомами анемії застосовується найнижча схвалена доза Аранеспу.
Після корегування будь-якої дози або режиму дозування кожні 1-2 тижні слід перевіряти рівні гемоглобіну. Зміни дози у підтримуючій фазі лікування слід робити не частіше, ніж кожні 2 тижні.
При зміні шляху введення слід застосовувати ту ж саму дозу та перевіряти рівні гемоглобіну кожні 1-2 тижні, щоб відповідним чином скорегувати дозу для підтримання гемоглобіну на бажаному рівні.
Клінічні дослідження продемонстрували, що дорослих пацієнтів, які отримують r-HuEPO 1, 2 або 3 рази на тиждень, можна переводити на лікування Аранеспом з режимом дозування 1 раз на тиждень або 1 раз через тиждень. Початкову щотижневу дозу Аранеспу (мкг/тиждень) можна визначити, розділяючи загальну тижневу дозу r-HuEPO (МО/тиждень) на 200. Початкову дозу Аранеспу, що застосовується через тиждень (мкг/через тиждень), можна визначити, розділяючи загальну кумулятивну дозу r-HuEPO, що її застосовують протягом двотижневого періоду, на 200. Через індивідуальну варіабельність для окремих пацієнтів може виникнути потреба у титруванні до оптимальних терапевтичних доз. При переведенні з r?HuEPO на Аранесп кожні 1-2 тижні слід контролювати рівень гемоглобіну та застосовувати один і той же шлях введення.
Діти з хронічною нирковою недостатністю
Фаза корекції
Для дітей віком від 11 років початкова доза, яку вводять підшкірно або внутрішньовенно, становить 0,45 мкг/кг маси тіла одноразовою ін’єкцією 1 раз на тиждень. Альтернативно пацієнтам, які не перебувають на діалізі, можна підшкірно вводити початкову дозу 0,75 мкг/кг маси тіла одноразовою ін’єкцією 1 раз кожні 2 тижні. Якщо збільшення рівня гемоглобіну є недостатнім (менше 10 г/л за 4 тижні), дозу слід збільшити приблизно на 25 %. Не слід збільшувати дозу частіше ніж 1 раз кожні 4 тижні.
Якщо підвищення гемоглобіну становить понад 20 г/л за 4 тижні, дозу необхідно зменшити приблизно на 25 % залежно від швидкості підвищення. Якщо рівень гемоглобіну перевищує 120 г/л, слід розглянути необхідність зменшення дози. Якщо рівень гемоглобіну продовжує зростати, дозу слід зменшити приблизно на 25 %. Якщо після зменшення дози гемоглобін продовжує зростати, дозу слід тимчасово відмінити, поки гемоглобін не почне знижуватися, а в цей момент терапію слід розпочати знову при дозі, що є приблизно на 25 % нижчою за попередню.
Рівень гемоглобіну слід вимірювати кожні 1-2 тижні, доки він не стабілізується. Після цього рівень гемоглобіну можна вимірювати через більші інтервали.
Корекція анемії для дітей із застосуванням Аранеспу 1 раз на місяць не вивчалася.
Підтримуюча фаза
Для дітей віком від 11 років у підтримуючій фазі можна продовжувати застосовувати Аранесп як одноразову ін’єкцію 1 раз на тиждень або 1 раз кожні 2 тижні. Пацієнти, які перебувають на діалізі, яких переводять з режиму дозування Аранеспу 1 раз на тиждень на режим дозування через тиждень, мають спочатку отримати дозу, вдвічі більшу за попередню дозу, яку вводили 1 раз на тиждень.
Пацієнтам, які не перебувають на діалізі, після досягнення бажаного рівня гемоглобіну при режимі дозування 1 раз кожні 2 тижні Аранесп можна вводити підшкірно 1 раз на місяць, застосовуючи початкову дозу, що вдвічі перевищує попередню дозу, що вводили 1 раз кожні 2 тижні.
Клінічні дослідження продемонстрували, що дітей, які отримують r-HuEPO 2 або 3 рази на тиждень, можна переводити на лікування Аранеспом з режимом дозування 1 раз на тиждень, а тих, які отримують r-HuEPO 1 раз на тиждень, можна переводити на лікування Аранеспом з режимом дозування 1 раз через тиждень. У дітей початкову щотижневу дозу Аранеспу (мкг/тиждень) можна визначити, розділяючи загальну тижневу дозу r-HuEPO (МО/тиждень) на 240. Початкову щотижневу дозу Аранеспу наступного тижня (мкг/тиждень) можна визначити, розділяючи загальну дозу r-HuEPO, застосовану протягом 2 тижнів, на 240. Через індивідуальну варіабельність окремим пацієнтам може бути потрібне титрування до оптимальних терапевтичних доз. При переході з r-HuEPO на Аранесп кожні 1-2 тижні слід контролювати рівень гемоглобіну та застосовувати один і той же шлях введення.
Дозу слід титрувати за потребою для підтримання бажаного рівня гемоглобіну.
Якщо для підтримання гемоглобіну на бажаному рівні необхідне корегування дози, рекомендується корегувати дозу приблизно на 25 %.
Якщо підвищення гемоглобіну становить понад 20 г/л за 4 тижні, дозу необхідно зменшити приблизно на 25 % залежно від швидкості підвищення. Якщо рівень гемоглобіну перевищує 120 г/л, слід розглянути питання щодо необхідності зменшення дози. Якщо рівень гемоглобіну продовжує зростати, дозу слід зменшити приблизно на 25 %. Якщо після зменшення дози гемоглобін продовжує зростати, дозу слід тимчасово відмінити, поки гемоглобін не почне знижуватися, а в цей момент терапію слід розпочати знову при дозі, що є приблизно на 25 % нижчою за попередню.
Слід ретельно стежити за пацієнтами, щоб упевнитися у тому, що для забезпечення адекватного контролю за симптомами анемії застосовується найнижча схвалена доза Аранеспу.
Після корегування будь-якої дози або режиму дозування кожні 1-2 тижні слід перевіряти рівень гемоглобіну. Змінювати дози у підтримуючій фазі лікування слід не частіше, ніж кожні два тижні.
При зміні шляху введення слід застосовувати ту ж саму дозу та перевіряти рівень гемоглобіну кожні 1-2 тижні, щоб відповідним чином скорегувати дозу для підтримання гемоглобіну на бажаному рівні.
Лікування симптоматичної анемії, спричиненої хіміотерапією, в онкохворих пацієнтів
У пацієнтів з анемією (наприклад, концентрація гемоглобіну ≤ 100 г/л) Аранесп слід вводити підшкірно, щоб підвищити рівень гемоглобіну не більше 120 г/л. Симптоми та наслідки анемії можуть варіюватися залежно від віку, статі та загальної тяжкості захворювання; необхідно, щоб лікар оцінив індивідуальний перебіг захворювання та стан пацієнта.
Через наявність варіабельності між пацієнтами іноді у пацієнта можуть спостерігатися індивідуальні значення гемоглобіну, що є нижчими та вищими за бажаний рівень гемоглобіну. Варіабельність гемоглобіну слід контролювати шляхом підбору дози з урахуванням цільових меж гемоглобіну від 100 г/л до 120 г/л. Слід уникати тривалого рівня гемоглобіну понад 120 г/л; інформація щодо відповідного корегування дози у випадках, коли спостерігаються значення гемоглобіну, що перевищують 120 г/л, наводиться нижче.
Рекомендована початкова доза становить 500 мкг (6,75 мкг/кг), яку вводити 1 раз кожні 3 тижні, при режимі дозування 1 раз на тиждень можна вводити дозу 2,25 мкг/кг маси тіла. Якщо клінічна відповідь пацієнта (слабкість, відповідь гемоглобіну) є неадекватною через 9 тижнів, подальша терапія не може бути ефективною.
Терапію Аранеспом слід припинити приблизно через 4 тижні після закінчення хіміотерапії.
Після досягнення терапевтичної мети для окремого пацієнта дозу слід зменшити на 25-50 %, щоб для підтримання гемоглобіну на рівні, що контролює симптоми анемії, застосовувати найнижчу схвалену дозу Аранеспу. Слід враховувати необхідність відповідного титрування дози між 500 мкг, 300 мкг та 150 мкг.
Слід ретельно стежити за пацієнтами; якщо рівень гемоглобіну перевищує 120 г/л, дозу слід зменшити приблизно на 25-50 %. Лікування Аранеспом слід тимчасово припинити, якщо рівень гемоглобіну перевищує 130 г/л. Після зниження рівня гемоглобіну до 120 г/л або нижче терапію слід поновити при дозі, що приблизно на 25 % є нижчою за попередню.
При зростанні рівня гемоглобіну більш ніж на 20 г/л за 4 тижні дозу слід зменшити на
25-50 %.
Діти.
Аранесп можна призначати дітям віком від 11 років.
Побічні реакції Аранесп розчин д/ін., 100 мкг/мл по 0,3 мл у поперед. запов. шпр. №1
Профіль безпеки
Відомими побічними реакціями, пов’язаними із застосуванням Аранеспу, є артеріальна гіпертензія, інсульт, тромбоемболічні явища, судоми, алергічні реакції, висип/еритема та істинна еритроцитарна аплазія (PRCA) (див. розділ «Особливі заходи безпеки»).
У дослідженнях, в яких Аранесп вводили підшкірно, повідомлялося про біль у місці введення, що пов’язували з лікуванням. Дискомфорт у місці введення, як правило, мав помірний та тимчасовий характер і спостерігався переважно після першої ін’єкції.
Перелік побічних реакцій
Перелік побічних реакцій представлено нижче за системами органів та частотою. Частота визначається як: дуже поширені (≥ 1/10); поширені (≥ 1/100, < 1/10); непоширені (≥ 1/1000, < 1/100); рідкісні (≥ 1/10 000, < 1/1000); дуже рідкісні (< 1/10 000), невідомо (частоту не невизначено, враховуючи наявні дані).
Дані про пацієнтів із хронічною нирковою недостатністю (ХНН) та онкохворих пацієнтів представлені окремо та відображають профіль різних побічних реакцій у цих категорій пацієнтів.
Пацієнти з хронічною нирковою недостатністю
|
Системи органів за MedDRA |
Частота виникнення у суб’єктів |
Небажана реакція на лікарський засіб |
|
З боку системи крові та лімфатичної системи |
Невідомо* |
Істинна еритроцитарна аплазія |
|
З боку імунної системи |
Дуже поширені* |
Гіперчутливість |
|
З боку нервової системи |
Поширені |
Інсульт |
|
Непоширені* |
Судоми |
|
|
З боку серця |
Дуже поширені |
Артеріальна гіпертензія |
|
З боку судин |
Непоширені |
Тромбоемболічні явища |
|
З боку шкіри та підшкірної тканини |
Поширені |
Висип/еритема |
|
Загальні порушення та стани у ділянці введення |
Поширені |
Біль у ділянці ін’єкції |
*Див. розділ «Окремі побічні реакції» нижче.
Онкохворі пацієнти
|
Системи органів за MedDRA |
Частота виникнення у суб’єктів |
Небажана реакція на лікарський засіб |
|
З боку імунної системи |
Дуже поширені* |
Гіперчутливість |
|
З боку нервової системи |
Непоширені* |
Судоми |
|
З боку серця |
Поширені* |
Артеріальна гіпертензія |
|
З боку судин |
Поширені |
Тромбоемболічні явища, включаючи легеневу емболію |
|
З боку шкіри та підшкірної тканини |
Поширені |
Висип/еритема |
|
Загальні порушення та стани у ділянці введення |
Дуже поширені |
Набряк |
|
Поширені |
Біль у ділянці ін’єкції |
*Див. розділ «Окремі побічні реакції» нижче.
Наведені нижче дані стосуються наслідків прийому Аранеспу і плацебо у 4 023 пацієнтів, які отримували принаймні одну дозу експериментального препарату дослідження «TREAT», що було рандомізованим плацебо-контрольованим клінічним дослідженням на когорті дорослих пацієнтів з ХНН, які не перебували на діалізі, з діабетом 2-го типу (див. розділ «Фармакодинаміка»).
Побічні реакції, що спостерігалися в ході дослідження «TREAT».
|
КЛАС ПОРУШЕНЬ З БОКУ СИСТЕМ ТА ОРГАНІВ |
|
Порушення з боку судин Артеріальна гіпертензія Гіпотензія |
|
Порушення з боку нирок та сечовивідних шляхів Хронічна ниркова недостатність |
|
Інфекції та інвазії Інфекція сечовивідних шляхів Назофарингіт Целюліт Синусит |
|
Порушення метаболізму і травлення Гіпоглікемія |
|
Порушення з боку нервової системи Запаморочення Головний біль |
|
Травми, отруєння та процедурні ускладнення Падіння Контузія |
|
Порушення з боку шкіри та підшкірної клітковини Висипання Виразка шкіри |
Окремі побічні реакції
Пацієнти з хронічною нирковою недостатністю
В окремих випадках повідомлялося про нейтралізуючу опосередковану антиеритропоетиновим антитілом істинну еритроцитарну аплазію (PRCA), повязану з терапією Аранеспом, переважно у хворих на ХНН, яким вводили лікарський засіб підшкірно. При діагностуванні PRCA терапію Аранеспом слід припинити, та пацієнтів не слід переводити на інший рекомбінантний еритропоетиновий білок (див. розділ «Особливі заходи безпеки»).
Частота всіх реакцій гіперчутливості оцінювалася, за даними клінічного дослідження, як дуже поширена у хворих на ХНН. Були повідомлення про серйозні реакції гіперчутливості, включаючи анафілактичну реакцію, набряк Квінке, алергічний бронхоспазм, шкірний висип і кропив'янку, пов'язані з дарбепоетином альфа.
У пацієнтів, що застосовували дарбепоетин альфа, траплялися судоми (див. розділ «Особливі заходи безпеки»).
Онкологічні пацієнти
Артеріальна гіпертензія спостерігалася в онкологічних хворих при застосуванні у постмаркетинговий період (див. розділ «Особливі заходи безпеки»).
В онкологічних пацієнтів, як і в групах плацебо, частота, за даними клінічного дослідження, оцінювалась як поширена.
Реакції гіперчутливості спостерігалися в онкохворих пацієнтів при застосуванні у постмаркетинговий період. Частота усіх реакцій гіперчутливості в онкохворих пацієнтів оцінювалась, за даними клінічного дослідження, як дуже поширена. Реакції гіперчутливості були також дуже поширеними у групах плацебо. Траплялись випадки серйозних реакцій гіперчутливості, включаючи анафілактичну реакцію, набряк Квінке, алергічний бронхоспазм, висип та кропив’янку, пов’язані із застосуванням дарбепоетину альфа.
Судоми спостерігались у пацієнтів при застосуванні дарбепоетину альфа у постмаркетинговий період (див. розділ «Особливі заходи безпеки»).
Педіатричні пацієнти з хронічною нирковою недостатністю
Дані стосовно безпеки застосування Аранеспу для педіатричних пацієнтів обмежені.
Безпечність застосування Аранеспу оцінювалась у клінічному дослідженні педіатричних пацієнтів з ХНН (від 1 до 18 років), які перебували або не перебували на діалізі, але стабільно застосовували епоетин альфа, а потім їх переводили на Аранесп для підтримки рівня гемоглобіну. Не було виявлено ніяких додаткових побічних реакцій у педіатричних пацієнтів у порівнянні з побічними реакціями у дорослих.
Передозування Аранесп розчин д/ін., 100 мкг/мл по 0,3 мл у поперед. запов. шпр. №1
Не визначено максимальну дозу Аранеспу, яку можна безпечно застосовувати одноразово або багаторазово. Наслідком терапії Аранеспом може бути поліцитемія, якщо уважно не слідкувати за рівнем гемоглобіну та коректністю дозування. Траплялися випадки тяжкої артеріальної гіпертензії при передозуванні Аранеспом (див. розділ «Особливі заходи безпеки»).
У випадку поліцитемії Аранесп слід тимчасово відмінити (див. розділ «Спосіб застосування та дози»). При наявності клінічних показань можна провести флеботомію.
Застосування в період вагітності або годування груддю Аранесп розчин д/ін., 100 мкг/мл по 0,3 мл у поперед. запов. шпр. №1
Немає достовірних та добре вивчених даних щодо застосування Аранеспу у період вагітності. Оскільки відсутній клінічний досвід застосування Аранеспу вагітним, у період вагітності від застосування препарату слід утримуватись.
Оскільки клінічний досвід застосування жінкам, які годують груддю, відсутній, слід припинити годування груддю у випадках, коли назначена терапія Аранеспом.
При дослідженні на тваринах не було виявлено прямого шкідливого впливу на вагітність, ембріональний/фетальний розвиток, пологи або постнатальний розвиток, не було впливу на фертильність.
Умови зберігання Аранесп розчин д/ін., 100 мкг/мл по 0,3 мл у поперед. запов. шпр. №1
Термін придатності
3 роки.
Умови зберігання
Зберігати в холодильнику (2 °С-8 °C).
Не заморожувати.
Зберігати в оригінальній упаковці для захисту від світла.
Зберігати в недоступному для дітей місці.
Упаковка
25 мкг/мл
Попередньо наповнений шприц з автоматичним запобіжником голки 0,4 мл № 1 у блістері в коробці.
Попередньо наповнений шприц 0,4 мл № 1 в коробці.
Попередньо наповнений шприц 0,4 мл № 1 у блістері в коробці.
100 мкг/мл
Попередньо наповнені шприци з автоматичним запобіжником голки 0,3 мл № 1 у блістері в коробці.
Попередньо наповнені шприци 0,3 мл № 1 в коробці.
Попередньо наповнені шприци 0,3 мл № 1 у блістері в коробці.
500 мкг/мл
Попередньо наповнені шприци з автоматичним запобіжником голки 1,0 мл № 1 у блістері в коробці.
Попередньо наповнені шприци 1,0 мл № 1 в коробці.
Попередньо наповнені шприци 1,0 мл № 1 у блістері в коробці.
Категорія відпуску
За рецептом.
Реєстраційні дані Аранесп розчин д/ін., 100 мкг/мл по 0,3 мл у поперед. запов. шпр. №1
Виробник: Амджен Європа Б.В., Нідерланди
Фарм. група: Антианемічні засоби. Інші протианемічні засоби.
Реєстрація: № UA/11437/01/03 від 15.09.2016. Наказ № 973 від 15.09.2016
МНН: Darbepoetin alfa
Код АТХ:
(B) Лікарські засоби, що впливають на кровотворення та кров
(B03) Антианемічні препарати
(B03X) Інші протианемічні препарати
(B03XA) Інші протианемічні препарати
(B03XA02) Дарбепоетин альфа
Дата оновлення информації: 23.11.2021 р.
© likiteka 2025
- Гематоgood (Гематогуд) батончик Какао 40 г, Риф ТОВ (Україна)
- Гематоgood (Гематогуд) батончик Курага 40 г, Риф ТОВ (Україна)
- Гематоgood (Гематогуд) з Кокосом, батончик, 40 г, Риф ТОВ (Україна)
- Гемоладік батончик 50 г з альбуміном №1, Кріоліт-Д (Україна, Дніпро)
- Заліза фумарат Golden Pharm табл. №36, Голден-Фарм (Київ)
- Гемато-Хелз з молоком і корицею до кави по 40 г, ТОВ "Вітапак" (Україна, Дніпро)
- Тайфер капсули №30 (15х2), Аконітум ЗАТ (Литва)
- Гематовіт альбумін+ арахіс шок.гл. 50г, ТОВ "Вітапак" (Україна, Дніпро)
- Гематовіт альбумін + родз. шок.гл. 50г, Туркуаз ЛТД
- Гематовіт альбумін+ курага шок.гл. 50г, Туркуаз ЛТД
- Гематовіт альбумін+ чорнослив шок.гл. 50г, Туркуаз ЛТД
- Ферсінол-3 капсули №30, Ейпіко для "Уорлд Медицин Лтд", Єгипет/Великобританія
- Амінозандра капс. 1040 мг №15, Зандра Лайфсайенсиз /Zandra Lifesciences Pvt Ltd. (Індія)
- Бінокрит р-н д/ін. 1000 МО шприц 0,5 мл №6, Сандоз ГмбХ, Австрія
- Бінокрит р-н д/ін. 2000 МО шприц 1 мл №6, Сандоз ГмбХ, Австрія