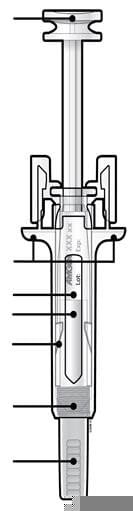
Проліа розчин д/ін., 60 мг/мл по 1 мл у шпр. скл. №1 з голк.
Амджен Мануфекчурінг Лтд для "ГлаксоСмітКляйн", Пуерто-Ріко, США/ВеликобританіяСклад
діюча речовина: деносумаб;
1 мл розчину містить 60 мг деносумабу;
допоміжні речовини: кислота оцтова льодяна, натрію гідроксид, сорбіт (E 420), полісорбат 20 (лише у попередньо заповненому шприці), вода для ін’єкцій.
Лікарська форма
Розчин для ін’єкцій.
Основні фізико-хімічні властивості: майже прозорий, безбарвний або жовтуватий розчин, що практично не містить сторонніх часток.
Фармакотерапевтична група
Лікарські засоби для лікування захворювань кісток, інші лікарські засоби, що впливають на структуру та мінералізацію кісток. Код АТХ M05B X04.
Фармакологічні властивості
Фармакодинаміка.
Деносумаб – це моноклональне антитіло людини (IgG2), мішенню для якого є RANKL, з яким препарат зв’язується з високою афінністю та специфічністю, запобігаючи активації його рецептора RANK на поверхні прекурсорів остеокластів та остеокластів. Запобігання взаємодії RANKL/RANK пригнічує утворення остеокластів, погіршує їх функціонування та життєздатність, таким чином зменшуючи резорбцію як трубчастих, так і губчастих кісток.
Лікування препаратом Проліа швидко зменшує рівень кісткового ремоделювання, досягаючи найнижчого рівня сироваткового маркера резорбції кісток – С-телопептидів колагену 1 типу (CTX) (85 % зменшення) – через 3 дні. Знижений рівень СТХ та утримується протягом усього інтервалу між застосуванням доз. В кінці кожного періоду після введення дози препарату ефект зниження рівня CTX був частково послаблений: з максимального зниження більш ніж на 87 % до зниження приблизно більш ніж на 45 % (у діапазоні від 45 до 80 %), що відображає оборотність ефектів деносумабу відносно ремоделювання кісткової тканини після зниження сироваткового рівня препарату. При продовженні терапії ці ефекти зберігалися.
Маркери ремоделювання кісткової тканини загалом досягали рівнів, на яких вони були до початку лікування препаратом, протягом 9 місяців після введення останньої дози. Після повторного ініціювання лікування рівень інгібування CTX деносумабом був подібним до того, що спостерігався у пацієнтів, які вперше розпочали лікування цим препаратом.
Імуногенність
За даними клінічних досліджень під час застосування препарату Проліа не спостерігалося вироблення нейтралізуючих антитіл. Менше 1 % пацієнтів, які лікувалися деносумабом не більше 5 років, мали позитивні тести (за даними чутливого імунологічного методу) на нейтралізуючі зв’язуючі антитіла без ознак впливу на фармакокінетику, токсичність або клінічний ефект.
Фармакокінетика.
Після підшкірного введення у дозі 1,0 мг/кг, що приблизно відповідає дозі 60 мг, концентрація препарату, базуючись на показниках AUC (площа під кривою «концентрація/час»), становила 78 % від рівня, отриманого при внутрішньовенному введенні цієї ж дози препарату. Після підшкірного введення 60 мг деносумабу максимальна сироваткова концентрація деносумабу (Cmax), що становить в середньому 6 мкг/мл (діапазон – 1-17 мкг/мл), досягається в середньому за 10 днів (діапазон – 2-28 днів). Після досягнення Cmax сироватковий рівень препарату знижується протягом 3 місяців (діапазон – 1,5-4,5 місяця) у зв’язку з періодом напіввиведення, що становить 26 днів (діапазон – 6-52 дні). У 53 % пацієнтів через 6 місяців після застосування препарату деносумаб не виявлявся.
У ході досліджень дозозалежності був виявлений нелінійний зв’язок фармакокінетики препарату з його дозою зі зменшенням кліренсу препарату при збільшенні його дози, але приблизне пропорційне дозозалежне зростання експозиції препарату спостерігається при застосуванні доз від 60 мг.
При багаторазовому застосуванні деносумабу в режимі 60 мг підшкірно 1 раз кожні 6 місяців не спостерігалося ані кумуляції препарату, ані змін його фармакокінетики з часом. На фармакокінетику деносумабу не впливало формування зв’язків антитіл з деносумабом, та фармакокінетика препарату була однаковою у жінок і чоловіків. Вік (28-87 років), расова приналежність, стан хвороби (втрата кісткової маси або остеопороз, рак передміхурової залози або рак молочної залози) не мали суттєвого впливу на фармакокінетику деносумабу.
Спостерігалася тенденція до збільшення маси тіла та зменшення експозиції препарату з огляду на показники AUC та Cmax. Однак така тенденція не вважається клінічно значущою, оскільки фармакодинамічний ефект оцінюється за маркерами ремоделювання кісток та збільшенням мінеральної щільності кісток, що були постійними у різних вагових категоріях хворих.
Як природний імуноглобулін деносумаб складається лише з амінокислот та вуглеводів, тому очікується, що метаболізм деносумабу буде здійснюватися звичайними шляхами виведення з організму імуноглобулінів, що буде обумовлювати його деградацію до малих пептидів та окремих амінокислот.
Дані доклінічних досліджень
При експозиції макак протягом вагітності при дозуванні на рівні AUC (площа під кривою «концентрація/час»), до 100 разів вищому ніж у людини (60 мг кожні 6 місяців), деносумаб не впливав на фертильність.
В дослідженні у макак, яким вводили деносумаб протягом І триместру вагітності, при дозуванні на рівні AUC, до 99 разів вищому за дозування у людини (60 мг кожні 6 місяців), не було виявлено негативного впливу на організми матері та плода. В цьому досліджені лімфатичні вузли плода не вивчали.
В іншому дослідженні у макак, яким вводили деносумаб протягом вагітності при дозуванні на рівні AUC, у 119 разів вищому за дозування у людини (60 мг кожні 6 місяців), було виявлено: підвищення рівнів мертвонародження та постнатальної летальності; порушення росту кісток, які проявлялися зниженням міцності кісток, зниженням гематопоезу та затримкою прорізування зубів; відсутність периферичних лімфатичних вузлів та зниження неонатального росту плода. Розвиток молочних залоз макак не відрізнявся від норми.
Дослідження на нокаутних мишах (генетично модифіковані миші, у яких RANKL, що є мішенню для деносумабу, відключено через видалення гена) дають змогу припустити, що відсутність RANKL впливає на дозрівання молочних залоз, що призводить до порушень годування груддю після пологів.
Спеціальні групи хворих
У дослідженні за участю 55 пацієнтів з різними стадіями ниркової недостатності, включаючи пацієнтів, які потребували діалізу, рівень ниркової недостатності не впливав на фармакокінетику деносумабу.
Спеціальних досліджень за участю пацієнтів з печінковою недостатністю не проводилось. Загалом моноклональні антитіла не виводяться шляхом печінкового метаболізму, тому очікується, що печінкова недостатність не буде мати впливу на фармакокінетику деносумабу.
Фармакокінетика препарату у пацієнтів літнього віку не визначалась.
Показання Проліа розчин д/ін., 60 мг/мл по 1 мл у шпр. скл. №1 з голк.
Лікування остеопорозу у жінок у постменопаузальному періоді та у чоловіків із підвищеним ризиком переломів. У жінок у постменопаузальному періоді препарат Проліа значно зменшує ризик переломів хребців, переломів нехребцевої локалізації та переломів стегна.
Лікування втрати кісткової маси у чоловіків з підвищеним ризиком переломів хребців, які отримують гормоносупресивну терапію у зв’язку з раком передміхурової залози.
Протипоказання Проліа розчин д/ін., 60 мг/мл по 1 мл у шпр. скл. №1 з голк.
Гіперчутливість до діючої речовини або до будь-якого з допоміжних компонентів препарату. Гіпокальціємія.
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Клінічних даних стосовно взаємодії деносумабу та гормональної замісної терапії (естрогенів) немає, однак потенційна можливість фармакодинамічної взаємодії вважається низькою.
За даними дослідження, у жінок у постменопаузальному періоді, які були переведені з попередньої терапії алендронатом на лікування деносумабом, фармакокінетика та фармакодинаміка деносумабу не змінилися після попереднього застосування алендронату.
У дослідженні взаємодії було встановлено, що препарат Проліа (60 мг підшкірно) не впливає на фармакокінетику мідазоламу, що метаболізується за допомогою цитохрому Р450 ЗА4 (CYP3A4). Це свідчить про відсутність впливу препарату на фармакокінетику лікарських засобів, що метаболізуються цим ферментом.
Особливості застосування
Поповнення кальцію та вітаміну D
Для всіх пацієнтів дуже важливим є адекватне вживання кальцію та вітаміну D.
Гіпокальціємія
Важливо ідентифікувати пацієнтів з ризиком виникнення гіпокальціємії та скорегувати гіпокальціємію за допомогою адекватного вживання кальцію та вітаміну D до початку лікування препаратом. Протягом лікування, особливо в перші декілька тижнів, рекомендований клінічний моніторинг рівнів кальцію у крові пацієнтів, схильних до розвитку гіпокальціємії. Якщо у будь-якого пацієнта на тлі лікування препаратом можна запідозрити симптоми гіпокальціємії (див. розділ «Побічні реакції»), слід визначити рівень кальцію.
В умовах постмаркетингового спостереження були отримані повідомлення про важку симптоматичну гіпокальціємію (див. розділ «Побічні реакції»), яка в більшості випадків виникала в перші тижні після початку лікування, але може також виникати пізніше.
Інфекції шкіри
У пацієнтів, які приймають препарат Проліа, можуть виникнути інфекції шкіри (переважно целюліт), що призводять до госпіталізації (див. розділ «Побічні реакції»). Пацієнтам необхідно негайно звернутися за медичною допомогою, якщо у них з’являться симптоми целюліту.
Остеонекроз щелепи
Отримані рідкісні повідомлення про остеонекроз щелепи у пацієнтів, які перебувають на лікуванні остеопорозу препаратом Проліа (див. розділ «Побічні реакції»).
У пацієнтів, які отримували деносумаб у дозі 60 мг кожні 6 місяців, повідомлялося про поодинокі випадки остеонекрозу щелепи. Остеонекроз щелепи виникав переважно у пацієнтів з розповсюдженим раком, які лікувались деносумабом у дозі 120 мг 1 раз на місяць.
Пацієнтам з ураженнями м’яких тканин ротової порожнини, які не загоюються, слід на один місяць відкласти початок/новий курс лікування.
Перед лікуванням препаратом Проліа хворим із супутніми факторами ризику потрібна попередня консультація стоматолога з проведенням відповідних профілактичних заходів та індивідуальної оцінки співвідношення ризику/користі.
Фактори, які слід взяти до уваги при оцінці ризику розвитку у пацієнта остеонекрозу щелепи:
- сила лікарського засобу, який гальмує резорбцію кістки (більший ризик для більш потужних сполук), шлях введення (більший ризик для парентерального введення) та кумулятивна доза препарату для лікування резорбції кістки;
- рак, супутні стани (наприклад анемія, коагулопатії, інфекції), паління;
- супутня терапія: кортикостероїди, хіміотерапія, інгібітори ангіогенезу, радіотерапія голови та шиї;
- погана гігієна порожнини рота, захворювання періодонту, невідповідне протезування зубів, хвороба зубів в анамнезі, інвазивні стоматологічні процедури, наприклад екстракції зубів.
Під час лікування препаратом Проліа слід дотримуватися відповідних правил гігієни порожнини рота, проходити регулярні профілактичні огляди у стоматолога та негайно повідомляти про будь-які симптоми з боку ротової порожнини, включаючи рухливість зубів, біль або набряки, рани, які не загоюються, або виділення з ран протягом лікування препаратом Проліа.
Під час лікування такі пацієнти повинні за можливості уникати інвазивних стоматологічних процедур. Якщо після уважного розгляду прийнято рішення щодо необхідності проведення інвазивних стоматологічних процедур, їх не слід проводити у дні безпосередньо перед або відразу після введення препарату Проліа. виникнення остеонекрозу щелепи під час лікування препаратом потребує проведення лікарем пацієнта разом із стоматологом або хірургом клінічної оцінки та складання плану лікування пацієнта, що базується на індивідуальній оцінці співвідношення ризику/користі з тимчасовою зупинкою лікування препаратом Проліа поки остеонекроз щелепи не буде подолано та фактори ризику не будуть пом’якшені.
Ризик виникнення остеонекрозу щелепи може збільшуватись із зростанням тривалості застосування препарату Проліа.
Атипові переломи стегна
У хворих, які лікувались препаратом Проліа, повідомлялось про випадки атипових переломів стегна (див. розділ «Побічні реакції»). Атипові переломи стегна можуть виникати при незначних травмах або при відсутності травм у підвертлюжній або діафізальній ділянці стегна та можуть бути двобічними. Ці переломи характеризуються специфічними радіографічними показниками. Про атипові переломи стегна також повідомлялось у пацієнтів з певними коморбідними станами (наприклад дефіцитом вітаміну D, ревматоїдним артритом, гіпофосфатазією) та при застосуванні певних фармацевтичних засобів (наприклад, біфосфонатів, глюкокортикоїдів, інгібіторів протонної помпи). Такі явища також виникали без антирезорбтивної терапії. Під час лікування препаратом Проліа пацієнтів слід попередити про необхідність повідомляти про нові або незвичайні випадки болю у стегновій кістці, стегні або у паховій ділянці. Пацієнтів, які мають такі симптоми, необхідно обстежити на наявність неповних переломів стегна, обстеженню також підлягає стегно протилежної ноги.
Сухий природний каучук
Ковпачок голки на попередньо заповненому шприці одноразового використання містить сухий природний каучук (похідна латексу), що може спричинити алергічну реакцію.
Сумісне лікування з іншими лікарськими засобами, що містять деносумаб
Пацієнти, які лікуються препаратом Проліа, не повинні одночасно приймати інші лікарські засоби, що містять деносумаб (для профілактики уражень кісткової системи у дорослих хворих з метастазами у кістки із солідних новоутворень).
Ниркова недостатність
У пацієнтів з тяжкою нирковою недостатністю (кліренс креатиніну < 30 мл/хв) або у тих, хто перебуває на діалізі, збільшується ризик розвитку гіпокальціємії. Ризик розвитку гіпокальціємії та супутнього гіперпаратиреозу підвищується зі збільшенням ступеня ниркової недостатності. Для цих пацієнтів особливо важливі адекватне вживання кальцію, вітаміну D та регулярний моніторинг рівня кальцію (див. початок розділу).
Супутні речовини
Пацієнти із рідкісною вродженою непереносимістю фруктози не повинні застосовувати препарат Проліа.
Препарат містить менше ніж 1 ммоль натрію (23 мг) на 60 мг, тобто, по суті, є вільним від натрію.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Препарат Проліа не має або має дуже незначний вплив на швидкість реакції при керуванні автотранспортом або роботі з іншими механізмами.
Спосіб застосування та дози Проліа розчин д/ін., 60 мг/мл по 1 мл у шпр. скл. №1 з голк.
Препарат застосовують підшкірно.
Дозування
Рекомендована доза препарату Проліа – одна підшкірна ін’єкція 60 мг препарату 1 раз кожні 6 місяців, що вводиться у стегно, живіт або зовнішню поверхню плеча.
Протягом терапії пацієнти як доповнення до лікування повинні отримувати препарати та харчові добавки, що містять кальцій та вітамін D (див. розділ «Особливості застосування»).
Спосіб застосування
Препарат для підшкірного введення. Препарат повинні застосовувати пацієнти, які пройшли інструктаж з техніки ін’єкційного введення.
Перед застосуванням розчин Проліа необхідно оглянути на наявність твердих часточок або зміни кольору. Розчин не можна використовувати, якщо він помутнів або змінив свій колір. Не струшувати. Для запобігання дискомфорту у місці ін’єкції необхідно дати попередньо заповненому шприцу нагрітися до кімнатної температури (до 25 °C) перед ін’єкцією та вводити препарат повільно. Потрібно ввести весь вміст попередньо заповненого шприца. Будь-яку кількість лікарського засобу, що залишилася у попередньо заповненому шприці після ін’єкції, слід знищити згідно з діючими вимогами.
Ниркова недостатність
Змінювати дозу препарату для лікування хворих з нирковою недостатністю не потрібно (див. розділ «Особливості застосування» щодо рекомендацій стосовно контролю за вмістом кальцію).
Печінкова недостатність
Безпека та ефективність деносумабу для лікування пацієнтів з печінковою недостатністю не вивчалися.
Хворі літнього віку
Змінювати дозу препарату для лікування пацієнтів літнього віку не потрібно.
Вказівки для пацієнта щодо використання попередньо заповненого шприца з голкою, закритою ковпачком, із захисним пристроєм від випадкового уколу голкою
|
|
Схема пристрою |
|
|||||||||||||||||
|
|
До застосування |
Після застосування |
|
||||||||||||||||
|
|
|
|
|
|
|||||||||||||||
Перед застосуванням попередньо заповненого шприца з голкою, закритою ковпачком, прочитайте цю важливу інформацію:
- Не виконуйте ін’єкції самостійно до отримання інструкцій від Вашого лікаря чи медичного працівника.
- Препарат Проліа вводять шляхом ін’єкції у тканину, що розташована зразу під шкірою (підшкірна ін’єкція).
- Повідомте лікаря, якщо у вас є алергія на латекс (ковпачок для голки на попередньо заповненому шприці містить похідну латексу).
- Не видаляйте сірий ковпачок для голки з попередньо заповненого шприца поки Ви не будете готові до ін’єкції.
- Не використовуйте попередньо заповнений шприц, якщо перед тим він впав на тверду поверхню. Застосовуйте новий попередньо заповнений шприц та зверніться до свого лікаря або медичного працівника.
- Не активуйте попередньо заповнений шприц, якщо Ви не збираєтесь виконувати ін’єкцію.
- Не знімайте прозорий захисний пристрій від випадкового уколу голкою з попередньо заповненого шприца.
У разі виникнення питань зверніться до свого лікаря або медичного працівника.
Крок 1: Підготовка.
А. Витягніть контейнер з попередньо заповненим шприцом з упаковки та підготуйте необхідні для ін’єкції приладдя.
Для комфортної ін’єкції витримайте попередньо заповнений шприц при кімнатній температурі протягом 30 хвилин перед ін’єкцією. Ретельно вимийте свої руки з милом.
Покладіть шприц на добре освітлений чистий письмовий стіл. Знайдіть спиртові серветки, ватний тампон, марлеву серветку або пластир, а також контейнер для утилізації гострих відходів (не входять в комплект).
- Не намагайтеся зігріти шприц за допомогою джерела тепла, наприклад гарячою водою або у мікрохвильовій печі.
- Не залишайте попередньо заповнений шприц під прямими сонячними променями.
- Не струшуйте попередньо заповнений шприц.
- Зберігайте попередньо заповнені шприці у місцях, недоступних для дітей та захищених від світла.
Б. Відкрийте контейнер шприца, видаливши покриття. Видаліть попередньо заповнений шприц з контейнера.
Для безпечного застосування:
- Не торкайтеся поршня.
- Не торкайтеся сірого ковпачка для голки.
Тримати тут
В. Проведіть огляд лікарського засобу та попередньо заповненого шприца.
Не використовуйте попередньо заповнений шприц, якщо:
- Лікарський засіб непрозорий або має тверді часточки, розчин має бути прозорим, безбарвним або жовтуватого кольору.
- Будь-яка частина шприца має тріщини або зламана.
- Сірий ковпачок для голки відсутній або голка ним не повністю прикрита.
- Сплинув останній день місяця, який вказано на етикетці як кінцевий термін використання.
У всіх зазначених випадках зверніться до свого лікаря або медичного працівника.
Крок 2: Готовність.
А. Ретельно вимийте руки. Підготуйте та очистіть місце ін’єкції.
|
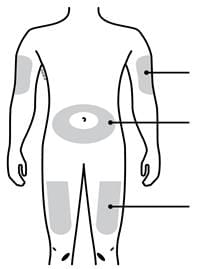
Місця для ін’єкції |
|
|
|
Зовнішня поверхня плеча (тільки якщо хтось проводить Вам ін’єкцію) Живіт, окрім 5-сантиметрової зони довкола пупка Верхня частина стегна |
Обробіть місце ін’єкції за допомогою серветки з етиловим спиртом. Дочекайтесь, щоб шкіра стала сухою.
- Не торкайтеся місця ін’єкції до її проведення.
- Не виконуйте ін’єкції у місця, де шкіра тонка, незвичайного кольору, напружена або порушена її цілісність. Уникайте ін'єкції в місця шрамів і розтяжок.
Б. Обережно зніміть сірий ковпачок з голки у напрямку, протилежному від вашого тіла.
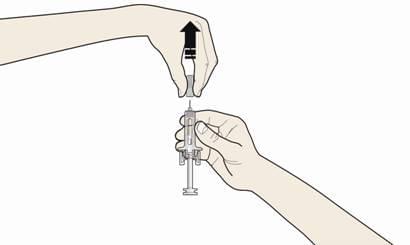
В. Затисніть місце ін'єкції, щоб створити міцну поверхню.
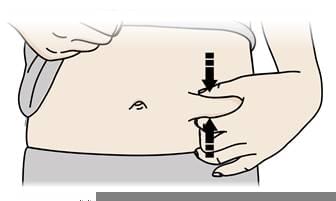
- Важливо тримати шкіру затиснутою при введенні.
Крок 3: Ін’єкція.
А. Тримаючи шкіру затиснутою, ВВЕДІТЬ голку у шкіру.
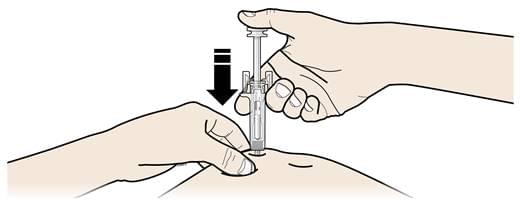
- Не торкайтеся обробленої ділянки шкіри.
Б. Повільно та постійно тисніть на поршень, просуваючи його, доки не відчуєте або не почуєте звук «тріску». Дотисніть поршень донизу.
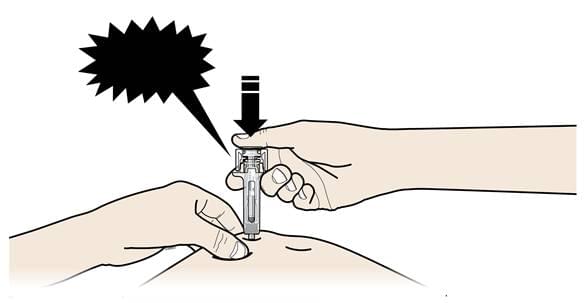
- Важливо натискувати на поршень до кінця до появи тріску задля введення повної дози.
В. Відпустіть великий палець. Потім підніміть шприц над шкірою.
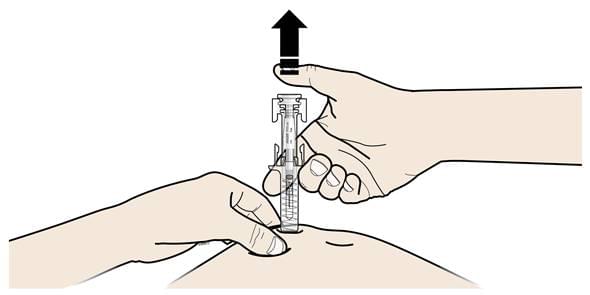
Після того, як Ви відпустили поршень, захисний пристрій від випадкового уколу голкою накриє голку.
- Не повертайте ковпачок на шприц, що був попередньо заповненим.
Крок 4: Завершення.
А. Утилізуйте використаний шприц та інші матеріали у контейнер для утилізації гострих відходів.
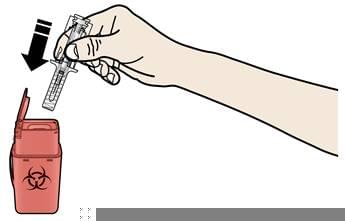
Ліки мають бути утилізовані відповідно до місцевих вимог. Не допускайте їх потрапляння в навколишнє середовище.
Зберігати шприц та контейнер для гострих відходів в недоступному для дітей місці та захищеному від світла місці.
- Повторно не використовуйте шприц, що був попередньо заповнений.
- Не переробляйте попередньо заповнені шприци та не викидайте їх у побутові відходи.
Б. Проведіть огляд місця ін’єкції.
Якщо є кров, притисніть ватний або марлевий тампон до місця ін’єкції. Не тріть місце ін'єкції. Нанесіть пластир, якщо це необхідно.
При утилізації використаних шприців:
- НЕ встановлюйте ковпачок для голки на використаний шприц.
- Тримайте використані шприци в недоступному для дітей місці.
Використані шприци потрібно утилізовати відповідно до місцевих вимог. Не допускайте їх потрапляння в навколишнє середовище.
Діти.
Препарат Проліа не рекомендований для застосування дітям, оскільки його безпека та ефективність для пацієнтів дитячого віку не встановлені. В експериментальних дослідженнях на тваринах інгібування рецептора-активатора ядерного фактора kB (RANK)/ліганду RANK (RANKL) супроводжувалося інгібуванням росту кісток та затримкою прорізування зубів.
Побічні реакції Проліа розчин д/ін., 60 мг/мл по 1 мл у шпр. скл. №1 з голк.
В таблиці 1 описані побічні реакції, щодо яких були повідомлення в ході клінічних випробувань фази II і III при застосуванні у хворих з остеопорозом і раком молочної залози або раком простати, які отримують гормональну терапію і/або спонтанні повідомлення.
Побічні реакції класифіковані у такі групи відповідно до частоти їх виникнення (див.табл. 1):
дуже часто( ³ 1/10), часто( ³ 1/100 та < 1/10), нечасто(³ 1/1000 та < 1/100), рідко (³ 1/10000 та < 1/1000), дуже рідко (< 1/10000).
У межах кожної групи побічні реакції вказані за частотою та системою та представлені в порядку зменшення частоти виникнення.
Таблиця 1
|
Система |
Категорія частоти |
Побічний ефект |
|
Інфекційні та паразитарні захворювання |
Часто
Нечасто
|
Інфекції сечовидільної системи, інфекції верхніх відділів дихальної системи Дивертикуліт, целюліт, інфекції вуха |
|
Розлади з боку імунної системи |
Рідко |
Медикаментозна гіперчутливість, анафілактична реакція |
|
Метаболічні та аліментарні розлади |
Рідко |
Гіпокальціємія1 |
|
Розлади з боку нервової системи |
Часто |
Ішіас |
|
Розлади з боку органів зору |
Часто |
Катаракта2 |
|
Розлади з боку шлунково-кишкового тракту |
Часто |
Запор, дискомфорт у животі |
|
Розлади з боку шкіри та підшкірної клітковини |
Часто Часто |
Висипання Екзема, включаючи дерматит, алергічний дерматит, атопічний дерматит та контактний дерматит |
|
Розлади з боку опорно-рухового апарату та сполучної тканини |
Дуже часто
|
Біль у кінцівках, біль у м’язах та кістках |
|
Рідко Рідко |
Остеонекроз щелепи Атипові переломи стегна3 |
1 Див. розділ «Особливості застосування».
2 у чоловіків з раком передміхурової залози, які отримували гормональну терапію.
3 у клінічних дослідженнях повідомлялося про випадки виникнення атипових переломів стегна у хворих, які лікувались препаратом Проліа.
Дані післяреєстраційного спостереження.
Реакції гіперчутливості
У хворих, які лікувалися препаратом Проліа, виникали реакції гіперчутливості що включали висипання, кропив’янку, припухлість обличчя, еритему та анафілактичні реакції.
Тяжка гіпокальціємія
У хворих зі збільшеним ризиком виникнення гіпокальціємії, які отримували препарат Проліа, повідомлялося про випадки тяжкої симптоматичної гіпокальціємії.
М’язово-скелетний біль
У хворих, які отримували препарат Проліа, повідомлялося про м’язово-скелетний біль, включаючи тяжкі випадки.
Опис окремих побічних реакцій
Гіпокальціємія
У двох плацебо-контрольованих клінічних дослідженях III фази у жінок в постменопаузі з остеопорозом, приблизно 0,05% (2 з 4050) мали зниження сироваткових рівнів кальцію (менше 1,88 ммоль / л) після введення препарату Проліа. Зниження сироваткових рівнів кальцію (менше 1,88 ммоль / л) не повідомлялось ні в двох плацебо-контрольованих клінічних дослідженях фази III у пацієнтів, які отримують гормональну терапію, ні в плацебо-контрольованому клінічному дослідженні фази III у чоловіків з остеопорозом. За даними постмаркетингового спостереження, повідомлялися рідкісні випадки тяжкої симптоматичної гіпокальціємії, переважно у пацієнтів з підвищеним ризиком виникнення гіпокальціємії, які приймали препарат Проліа, та переважно у перші тижні після початку терапії. Випадки клінічних проявів тяжкої симптоматичної гіпокальціємії включали пролонгацію інтервалу QT, тетанію, судоми і зміни психічного стану (див. розділ «Особливості застосування»). Симптоми гіпокальціємїї, які було виявлено у ході клінічних досліджень із застосуванням деносумабу, включали парестезії або жорсткість м'язів, посмикування, спазми і м'язові судоми.
Шкірні інфекції
У плацебо-контрольованих клінічних дослідженнях фази III, загальна частота інфекцій шкіри була подібною у групі плацебо і групі, де приймали препарат Проліа: у жінок в постменопаузі з остеопорозом (плацебо [1,2%, 50 з 4041] в порівнянні з препаратом Проліа [1,5%, 59 з 4050]); у чоловіків з остеопорозом (плацебо [0,8%, 1 з 120] в порівнянні з препаратом Проліа [0%, 0 з 120]); у пацієнтів з раком грудної залози або простати, які отримують гормональну терапію (плацебо [1,7%, 14 з 845] в порівнянні з препаратом Проліа [1,4%, 12 з 860]). Шкірні інфекції, що призвели до госпіталізації становили 0,1% (3 з 4041) серед жінок в постменопаузі з остеопорозом, які отримували плацебо в порівнянні з 0,4% (16 з 4050) серед жінок, які приймали препарат Проліа. У більшості випадків це був целюліт. Інфекції шкіри, які повідомлялись як серйозні побічні реакції, були подібними у групі плацебо (0,6%, 5 з 845) та групі, в якій приймали Проліа (0,6%, 5 з 860) в дослідженнях раку грудної залози і простати. Остеонекроз щелепи Випадки виникнення остеонекрозу щелепи повідомлялися рідко, у 16 хворих, в клінічних випробуваннях при остеопорозі та при раку грудної залози або раку простати у пацієнтів, які отримували гормональну терапіюї з загальною кількістю 23148 пацієнтів (див. розділ «Особливості застосування»). 13 з цих випадків сталися у жінок в постменопаузі з остеопорозом під час клінічного випробування фази III з продовженням подальшого лікування препаратом Проліа до 10 років (0,3%; <0,1 подій на 100 пацієнт - років).
Атипові переломи стегна
У пацієнтів, яким застосовували препарат Проліа згідно програми клінічних випробувань лікування остеопорозу, рідко повідомлялося про атипові переломи стегна (див. розділ «Особливості застосування»). Катаракта В фазі III одного плацебо-контрольованого клінічного дослідження пацієнтів з раком простати, які отримували андрогендеприваційну терапію (ADT), спостерігали дисбаланс у побічних реакціях відносно катаракти (4,7% - у групі деносумабу, 1,2% - у групі плацебо). Не спостерігали дисбалансу у жінок в постменопаузальному періоді або у чоловіків з остеопорозом або у жінок з лікуванням неметастатичного раку молочної залози інгібітором ароматази.
Дивертикуліт
В фазі III одного плацебо-контрольованого клінічного дослідження пацієнтів з раком простати, які отримували AD спостерігали дисбаланс у побічних реакціях відносно дивертикуліта (1,2% - у групі деносумабу, 0% - у групі плацебо). Захворюваність дивертикулитом була порівнянна між групами лікування у жінок в постменопаузальному періоді або чоловіків з остеопорозом і у жінок з лікуванням неметастатичного раку молочної залози інгібітором ароматази.
Медикаментозна гіперчутливість
При постмаркетингових спостереженнях у пацієнтів, що отримували лікування препаратом Проліа, спостерігалися рідкісні явища медикаментозної гіперчутливості, включаючи висипання, кропив’янку, набряк обличчя, еритему і анафілактичні реакції.
М’язово-скелетний біль
При постмаркетингових спостереженнях у хворих, які отримували препарат Проліа, повідомляли щодо м’язово-скелетного болю, включаючи тяжкі випадки. У клінічних випробуваннях м’язово-скелетний біль спостерігали дуже часто в обох групах дослідження: лікування деносумабом та плацебо. Нечасто повідомляли щодо м’язово-скелетного болю, що призводив до припинення лікування у клінічному дослідженні. Інші спеціальні групи пацієнтів У клінічних дослідженнях пацієнти з тяжкою нирковою недостатністю (кліренс креатиніну <30 мл/хв) або пацієнти, які отримують діаліз, піддаються більшому ризику гіпокальціємії за відсутності добавок кальцію. Адекватне споживання кальцію і вітаміну D має важливе значення у пацієнтів з тяжкою нирковою недостатністю або пацієнтів, які отримують діаліз (див. розділ «Особливості застосування»).
Передозування Проліа розчин д/ін., 60 мг/мл по 1 мл у шпр. скл. №1 з голк.
Не було отримано даних стосовно передозування препарату. При дозах до 180 мг кожні 4 тижні (кумулятивна доза – до 1080 мг за 6 місяців) не спостерігалося інших, окрім уже наведених, побічних ефектів.
Застосування в період вагітності або годування груддю Проліа розчин д/ін., 60 мг/мл по 1 мл у шпр. скл. №1 з голк.
Вагітність
Дані про безпеку застосування препарату вагітним наразі відсутні. В дослідженні на макаках, яким вводили деносумаб протягом вагітності при дозуванні на рівні AUC у 119 разів вищому за дозування у людини, було виявлено репродуктивну токсичність (див. розділ «Фармакологічні властивості»).
Препарат Проліа не рекомендований для застосування у період вагітності.
Годування груддю
Невідомо, чи екскретується деносумаб у грудне молоко людини. Дослідження на нокаутних мишах (генетично модифіковані миші, у яких RANKL, що є мішенню для деносумабу, відключено через видалення гена, (див. розділ «Фармакологічні властивості») дають змогу припустити, що відсутність RANKL впливає на дозрівання молочних залоз, що призводить до порушень годування груддю після пологів (див. розділ «Фармакологічні властивості»).
Рішення про відмову від грудного вигодовування або від лікування препаратом Проліа слід приймати, зважуючи переваги грудного вигодовування для немовляти та лікування препаратом Проліа для матері. При необхідності лікування слід відмовитись від грудного вигодовування.
Фертильність
Даних про вплив деносумабу на фертильність людини немає. Дослідження на тваринах не вказують на наявність прямих або непрямих негативних ефектів застосування препарату Проліа на фертильність (див. розділ «Фармакологічні властивості»).
Умови зберігання Проліа розчин д/ін., 60 мг/мл по 1 мл у шпр. скл. №1 з голк.
Зберігати у холодильнику при температурі 2-8 °C в оригінальній упаковці. Після вилучення з холодильника зберігати при температурі не вище 25 °C в оригінальній упаковці. Не заморожувати. Не струшувати. Термін придатності після вилучення з холодильника – 30 днів. Зберігати в недоступному для дітей місці.
Термін придатності
3 роки.
Упаковка
Попередньо заповнений шприц
Скляний попередньо заповнений шприц з голкою, закритою ковпачком, із захисним пристроєм від випадкового уколу голкою, що містить 1 мл розчину для ін’єкцій. По 1 попередньо заповненому шприцу з захисним пристроєм у блістері, поміщеному в картонну коробку,
або
скляний попередньо заповнений шприц з голкою, закритою ковпачком, що містить 1 мл розчину для ін’єкцій. По 1 попередньо заповненому шприцу в блістері або без блістера, поміщеному в картонну коробку.
Флакон
Скляний флакон із фторполімерною ламінованою еластомерною пробкою та алюмінієвою обкаткою з захисною пластиковою кришечкою, що містить 1 мл розчину для ін’єкцій. По 1 флакону в картонній коробці.
Категорія відпуску
За рецептом.
Реєстраційні дані Проліа розчин д/ін., 60 мг/мл по 1 мл у шпр. скл. №1 з голк.
Виробник: Амджен Мануфекчурінг Лтд для "ГлаксоСмітКляйн", Пуерто-Ріко, США/Великобританія
Фарм. група: Лікарські засоби для лікування захворювань кісток, інші лікарські засоби, що впливають на структуру
Реєстрація: № UA/12077/01/01 від 20.03.2017. Наказ № 295 від 20.03.2017
МНН: Denosumab
Код АТХ:
(M) Лікарські засоби для лікування захворювань кістково-м`язової системи
(M05) Препарати для лікування захворювань кісток
(M05B) Препарати, що впливають на мінералізацію кісток
(M05BX) Інші препарати, що впливають на мінералізацію кісток
(M05BX04) Деносумаб
Дата оновлення информації: 22.12.2022 р.
© likiteka 2025